|
|
|
|
|
Глава 9. Строение вещества § 47. Степень окисления
В каком состоянии атомы элементов проявляют валентность? Для характеристики состояния атомов в сложных веществах введено понятие «степень окисления». Степень окисления характеризует связанные между собой атомы в ионных и ковалентно-полярных соединениях.
Степень окисления — это количественная характеристика элемента в химическом соединении. При определении степени окисления атомов элементов исходят из предположения, что в соединении все связывающие атомы валентные электроны перешли к более электроотрицательному элементу, а потому соединение состоит из положительно и отрицательно заряженных ионов. Степень окисления определяется числом электронов, полностью или частично смещённых от одного атома к другому, с обозначением соответствующего заряда (+) или (-). В отличие от обозначения зарядов ионов (Cl-, S2-, К+, Са2+), которое ставят вверху справа символа элемента, степень окисления также обозначают цифрой со знаками (+) или (-), но её ставят над символом элемента, причём знак (+) или (-) ставят перед цифрой, например:
Степень окисления иногда называют также окислительным числом элемента. Вычисление степени окисления элементов в соединении требует учёта валентных электронов и направления их смещения при связывании атомов. Так, в хлориде водорода НС1 один электрон водорода смещён в сторону хлора. Водород имеет в соединении степень окисления, равную +1, а хлор -1, т. е. Степень окисления водорода в соединениях обычно равна +1, а кислорода -2. Зная это, легко найти степень окисления других элементов.
Аналогично определите степень окисления для S и Сr в соединениях Na2SO3 и Н2СrО4. Высшая положительная степень окисления элемента обычно равна номеру группы периодической системы. Так, кальций находится во II группе, следовательно, его высшая степень окисления равна +2, у элемента V группы азота она равна +5.
|
|
|



 Отличаются ли по электронной структуре и свойствам атомы элементов в свободном состоянии и в соединении?
Отличаются ли по электронной структуре и свойствам атомы элементов в свободном состоянии и в соединении?
 Степень окисления — это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
Степень окисления — это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
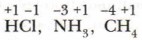
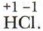 У атома азота три внешних неспаренных электрона, у атома водорода — один. При образовании химической связи в молекуле аммиака NH3 один атом азота как более электроотрицательный элемент оттягивает 3 электрона от 3 атомов водорода. Его степень окисления в соединении равна -3. В целом химическое соединение электронейтрально: сумма положительных степеней окисления равна сумме отрицательных степеней окисления составляющих его элементов.
У атома азота три внешних неспаренных электрона, у атома водорода — один. При образовании химической связи в молекуле аммиака NH3 один атом азота как более электроотрицательный элемент оттягивает 3 электрона от 3 атомов водорода. Его степень окисления в соединении равна -3. В целом химическое соединение электронейтрально: сумма положительных степеней окисления равна сумме отрицательных степеней окисления составляющих его элементов.
