|
|
|
|
|
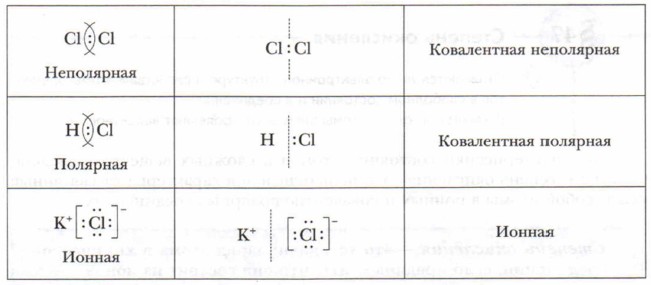
Глава 9. Строение вещества Ионная связь и её свойстваВажнейшими свойствами ионной связи являются её прочность, ненасыщенность, ненаправленность. Ионная связь весьма прочная. Так, например, энергия разрыва связи К— Сl равна 426,1 кДж/моль, связи Li—F — 577,3 кДж/моль, Na—Сl — 411,3 кДж/моль. Ненасыщенность её объясняется тем, что вокруг заряженной частицы — иона создаётся сферическое электромагнитное поле. Притяжение противоположно заряженных ионов в сферическом поле происходит во всех направлениях, поэтому ионная связь является ненаправленной. Вы познакомились с ковалентной (неполярной и полярной) и ионной химическими связями. Природа их одинакова — электрическая. Она связана с электрическим взаимодействием электронов и ядер атомов. Соединения ионного и ковалентно-полярного типа образованы атомами разных элементов с разной электроотрицательностью. В этих соединениях электронные пары, связывающие атомы, смещены к более электроотрицательному элементу. Наиболее полное смещение электронной пары или пар происходит в ионных соединениях. Экспериментальные исследования доказывают, что полного перехода электронов от атомов металлов к атомам неметаллов при образовании ионной связи не происходит. Поэтому в хлориде натрия (Na+Cl-) заряды его ионов не равны единице, а имеют в действительности заряды на ионах, равные +0,8 и -0,8 (реальные заряды на ионах называются эффективными зарядами). Чем больше разность между значениями ОЭО атомов, тем выше степень ионности их соединения. Связи с разностью ОЭО больше 2,1 можно отнести к ионным (более 50% ионности). Ионную связь можно рассматривать как предельный случай полярности ковалентной связи.
Чисто ионной связи практически не существует. Отсюда деление химической связи на типы — ковалентная и ионная также условно. Основные понятия Ионы • Катионы • Анионы • Ионная связь • Ионные соединения Вопросы и задания
|
|
|



 1. Какая химическая связь называется ионной и для каких элементов она характерна?
1. Какая химическая связь называется ионной и для каких элементов она характерна?
 2. На примере фторида лития объясните механизм его образования и запишите схему этого процесса.
2. На примере фторида лития объясните механизм его образования и запишите схему этого процесса.
 3. На основе строения атомов и места в периодической системе элементов калия и хлора дайте аргументированный прогноз относительно возможности образования между ними химической связи и её типа.
3. На основе строения атомов и места в периодической системе элементов калия и хлора дайте аргументированный прогноз относительно возможности образования между ними химической связи и её типа.
 4. В чём сходство и различия химической связи у соединений HF и NaF? Результаты сравнения изложите в форме таблицы.
4. В чём сходство и различия химической связи у соединений HF и NaF? Результаты сравнения изложите в форме таблицы.