|
|
|
|
|
Глава 10. Химические реакции в свете электронной теории § 49. Окислительно-восстановительные реакции
Вы уже знаете, что при образовании ионной химической связи между атомами разных по характеру элементов происходит полное или частичное перемещение валентных электронов к более электроотрицательному атому с образованием ионов. Для обозначения их истинного или условного заряда в соединении введено понятие «степень окисления». Задание. Дайте определение степени окисления. Как определить численное значение степени окисления? Определите степень окисления элементов в следующих соединениях: O2, KI, FeCl3, NaBr, K2SO3, KMnO4. В ионных соединениях степень окисления отражает истинный заряд ионов, что связано с переходом электронов от атомов металла к атомам неметалла:
Образование ионной связи можно представить в виде двух процессов:
Эти два процесса взаимосвязаны, так как электроны от одного атома переходят к другому атому. В обоих случаях это приводит к образованию устойчивых электронных структур. В химические реакции вступают не изолированные атомы, а реальные вещества, находящиеся в определённом агрегатном состоянии:
В определении процессов окисления и восстановления и числа смещаемых электронов можно опереться на следующий ряд изменения степеней окисления:
К восстановителям относятся атомы и простые вещества — металлы, молекулярный водород, сероводород, аммиак, оксид углерода (II) и др. В процессе отдачи электронов восстановитель окисляется.
Схема реакции:
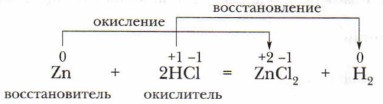
Окислитель (галогены, кислород, кислоты и др.) в этом процессе восстанавливается, а восстановитель (металлы, водород, углерод и др.) окисляется. В этих реакциях процессы окисления и восстановления взаимосвязаны. Особенность таких реакций заключается в том, что, кроме разрушения старых связей в исходных веществах и образования новых в продуктах реакции, происходит изменение степеней окисления атомов реагирующих веществ.
Изменение степени окисления атомов элементов в ходе превращения веществ — важнейший признак окислительно-восстановительных реакций (ОВР), по которому они распознаются и выделяются среди других. Окислительно-восстановительные реакции, как и другие реакции, подчиняются общему закону природы — закону сохранения массы и энергии. Конкретное его проявление в окислительно-восстановительных реакциях заключено в сохранении числа электронов в реакционной системе, т. е. число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Для ОВР характерны специфические закономерности протекания: 1. Единство, неразрывность окислительного и восстановительного процессов в реакциях данного вида. 2. Сохранение числа электронов в системе. Основные понятия Окисление • Восстановление • Окислитель • Восстановитель • Окислительно-восстановительная реакция Вопросы и задания
а) H2S → SO2 → SO3
Обсудите с товарищем, какой вывод можно сделать на основе выполнения задания.
1) Mg + НСl → MgCl2 + Н2
Составьте схему реакции 4, указав окислитель и восстановитель, окислительный и восстановительный процессы.
|
|
|



 Вспомните, что вам известно о степени окисления.
Вспомните, что вам известно о степени окисления.
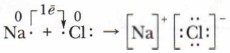
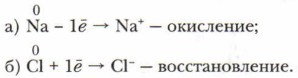
 Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
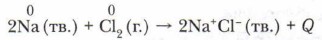

 1. Какова сущность процессов окисления и восстановления в свете электронных представлений?
1. Какова сущность процессов окисления и восстановления в свете электронных представлений?
 2. Что показывает степень окисления? Как она изменяется при окислении и восстановлении элементов?
2. Что показывает степень окисления? Как она изменяется при окислении и восстановлении элементов?
 3. Определите, окисляется или восстанавливается сера при переходах:
3. Определите, окисляется или восстанавливается сера при переходах: