|
|
|
|
|
Глава 10. Химические реакции в свете электронной теории § 50. Составление уравнений окислительно-восстановительных реакций
Химическое уравнение является моделью реальной химической реакции. Химическая реакция и её уравнение отражают закон сохранения массы веществ. В химии важно владеть языком формул и уравнений, которые в краткой и обзорной форме отражают закономерности состава и строения веществ, сущность и закономерности протекания химических реакций. Теория окислительно-восстановительных процессов включает их уравнения, требующие своеобразного оформления и умения их составлять. При составлении уравнений ОВР следует опираться на изученные ранее закономерности их протекания, умение отличать ОВР от других реакций. В основе их составления лежит молекулярное уравнение. Задание. Определите, окисляется или восстанавливается сера в ходе превращений: a) S → H2S б) S → SO2 Пример оформления задания:
Для составления уравнений ОВР надо учитывать неразрывность окисления и восстановления и сохранение при этом числа электронов, т. е. опираться на следующее правило.
Составление уравнения ОВР и расстановка в нём коэффициентов — достаточно сложные действия. Расставлять коэффициенты в уравнениях сложных ОВР путём их подбора, как это делали ранее, — дело не только трудное, но часто и невозможное. Упростить расстановку коэффициентов в уравнениях помогает метод электронного баланса. Он основан на правиле сохранения числа электронов в системе, отражающем суть метода. Для подбора коэффициентов методом электронного баланса составляют электронное уравнение. Первый способ:
Перед формулой восстановителя H2S ставится коэффициент 2, перед формулой окислителя O2 — коэффициент 3. Второй способ (краткая запись электронного баланса):
После тренировки в составлении уравнений ОВР любым из способов применения метода электронного баланса с учётом всех последовательных операций этого действия их можно свернуть в более обобщённые действия.
Основные понятия Окислительно-восстановительные реакции • Метод электронного баланса Вопросы и задания
NH3 + O2 → N2 + N2O
H2S + Cl2 + Н2О → H2SO4 + НСl
|
|
|



 Что называется химическим уравнением, каковы его смысл и значение? Какую роль в изучении химии играют схемы окислительно-восстановительных реакций? Сформулируйте закон сохранения масс. Дайте определение и раскройте смысл и значение коэффициентов.
Что называется химическим уравнением, каковы его смысл и значение? Какую роль в изучении химии играют схемы окислительно-восстановительных реакций? Сформулируйте закон сохранения масс. Дайте определение и раскройте смысл и значение коэффициентов.

 Число электронов, оттянутых восстановителем, должно быть равно числу электронов, притянутых окислителем.
Число электронов, оттянутых восстановителем, должно быть равно числу электронов, притянутых окислителем.
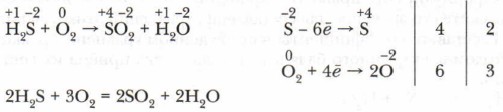
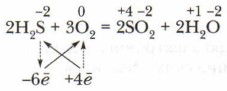

 1. Сформулируйте правило сохранения числа электронов в ОВР и укажите его значение для составления уравнений этих реакций.
1. Сформулируйте правило сохранения числа электронов в ОВР и укажите его значение для составления уравнений этих реакций.
 2. Расставьте коэффициенты в приведённом уравнении реакции
методом электронного баланса, используя два приёма их составления:
2. Расставьте коэффициенты в приведённом уравнении реакции
методом электронного баланса, используя два приёма их составления:
 4. Используя алгоритмическое предписание, расставьте коэффи циенты в следующем уравнении:
4. Используя алгоритмическое предписание, расставьте коэффи циенты в следующем уравнении:
 7. Выразите всю совокупность знаний, требуемых для истолкования сущности окислительно-восстановительных реакций, наглядной схемой. Результат работы обсудите с товарищем.
7. Выразите всю совокупность знаний, требуемых для истолкования сущности окислительно-восстановительных реакций, наглядной схемой. Результат работы обсудите с товарищем.