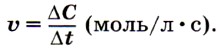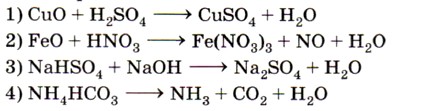|
|
|
|
|
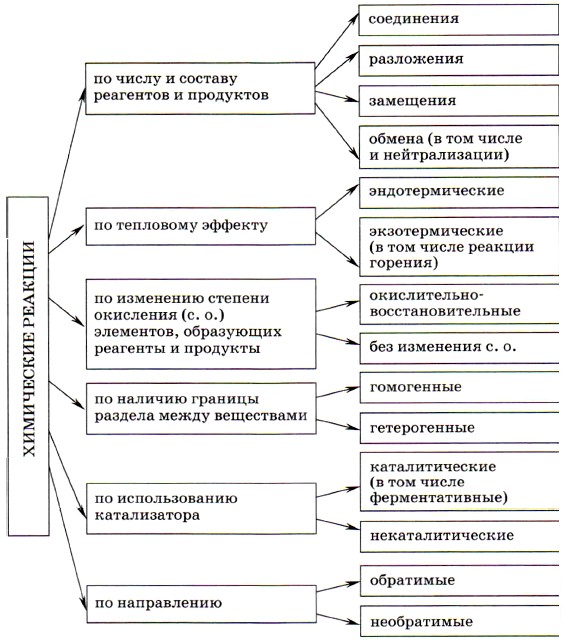
Глава 4. Обобщение знаний по химии за курс основной школы. Подготовка к ГИА § 38. Классификация химических реакций. Скорость химической реакцииКлассификация химических реакцийСхема 2.
Скорость химической реакцииСкорость химической реакции — изменение концентраций реагирующих веществ в единицу времени:
Факторы, влияющие на скорость химической реакции: Примечание. Для гетерогенных реакций скорость реакции зависит и от площади поверхности соприкосновения реагирующих веществ (для её увеличения твёрдые вещества измельчают, используют «кипящий слой» и др.). Катализаторы: Биологические катализаторы белковой природы называются ферментами (энзимами). Примеры тестовых заданий и рекомендации к их выполнению1. Соляная кислота вступает в реакцию замещения с 1) гидроксидом меди (II) 3) оксидом железа (И)
Элементарные сведения о реакции замещения как реакции простого и сложного веществ позволят исключить из числа возможных ответы 1 и 3, так как в них предложены сложные вещества. Ответ 2 неверен по своей химической сути — медь в ряду напряжений металлов находится после водорода. Ответ: 4. 2. К окислительно-восстановительным реакциям относятся реакции 1) обмена 3) замещения
Реакции обмена не относятся к окислительно-восстановительным, следовательно, условию задания не отвечают задания 1,2 и 4. Ответ: 3. 3. К экзотермическим реакциям не относится взаимодействие 1) оксида натрия с водой 3) оксида фосфора с водой
Все указанные в условии задания относятся к реакциям соединения, которые, как правило, являются экзотермическими реакциями, т. е. протекают с выделением теплоты. Одно из немногих исключений — взаимодействие азота с кислородом. Ответ: 4. 4. К эндотермическим процессам относится 1) гашение извести
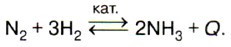
Очень сложное задание, требующее знаний тривиальных названий веществ и процессов, связанных с химией кальция. Гашением извести называется взаимодействие оксида кальция (негашёной извести) с водой. Известковым молоком называется взвесь гидроксида кальция в воде. Известковой водой называется раствор гидроксида кальция в воде. Реакции с участием этих соединений — экзотермические. Ответ: 2. К этому ответу можно прийти гораздо проще. Достаточно знать, что все реакции разложения относятся к эндотермическим, т. е. протекают с поглощением теплоты. Обжиг известняка — разложение карбоната кальция. 5. Верны ли следующие суждения применительно к реакции синтеза аммиака? А. Это реакция соединения, гомогенная, каталитическая.
1) верно только А 3) верны оба суждения
К верному ответу позволяет прийти запись уравнения реакции:
Ответ: 3. 6. К реакциям замещения и соединения относятся соответственно взаимодействия 1) оксид алюминия 4 + соляная кислота и оксид железа (III) + алюминий
Так как по условию задания первой в верном ответе должна быть реакция замещения (взаимодействие простого и сложного веществ), то определить верный ответ не составит труда. Ответ: 2 Остальные варианты ответов можно не анализировать. 7. С наибольшей скоростью при комнатной температуре протекает реакция между 1) кислородом и водородом
В растворах электролитов реакции ионного обмена протекают почти мгновенно. Ответ: 4. 8. С наибольшей скоростью с водородом реагирует 1)фтор 2) хлор 3) бром 4) иод Активность галогенов и их окислительные свойства уменьшается в подгруппе сверху вниз. Ответ: 1. 9. Верны ли следующие суждения о катализаторах? А. Это вещества, которые изменяют скорость химической реакции и расходуются при этом.
1) верно только А 3) верны оба суждения
Так как катализаторы по завершении каталитической реакции не меняются качественно и количественно, то суждение А неверно. Ответ: 2. 10. Верны ли следующие суждения о скорости химической реакции? А. Это величина, характеризующаяся изменением концентрации реагирующих веществ.
1) верно только А 3) верны оба суждения
Наиболее близко к истинному суждение А, но оно не содержит такой важнейшей характеристики скорости химической реакции, как отношение изменения концентрации реагирующих веществ ко времени, за которое оно произошло. Ответ. 4.
1. Взаимодействие алюминия с оксидом хрома (III) — это реакция 1) замещения 3) разложения
2. При сливании растворов иодида калия и нитрата свинца (II) протекает реакция 1) замещения 3) разложения
3. Хлор вступает в реакцию замещения с 1) хлоридом железа (II) 3) оксидом углерода (II)
4. Не является окислительно-восстановительной реакция, схема которой
5. Окислительно-восстановительная реакция лежит в основе получения 1) сульфата аммония из аммиака и серной кислоты
6. Эндотермическим процессом является 1) нейтрализация серной кислоты гидроксидом натрия
7. К реакциям обмена относится взаимодействие между 1) оксидом меди (II) и соляной кислотой
8. Окислительно-восстановительной является реакция, схема которой
9. Скорость реакции разложения пероксида водорода увеличится при 1) разбавлении раствора 3) внесении катализатора
10. Ингибитор — это вещество, которое 1) ускоряет химическую реакцию
Классификация химических реакций. Скорость химической реакции. Ответы
|
|
|