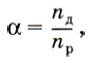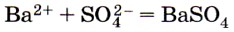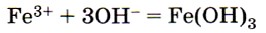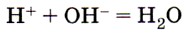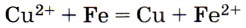|
|
|
|
|
Глава 4. Обобщение знаний по химии за курс основной школы. Подготовка к ГИА § 39. Диссоциация электролитов в водных растворах. Ионные уравнения реакцийЭлектролитическая диссоциация — распад электролита в растворе (расплаве) на ионы: Многоосновные кислоты и многокислотные основания диссоциируют ступенчато, но преимущественно протекает диссоциация по 1-й ступени.
где nд, и nр — соответственно количество вещества электролита, распавшегося на ионы и растворённого. По степени электролитической диссоциации электролиты делятся на сильные и слабые. Сильные (α → 1) электролиты: Слабые (α→ 0) электролиты: Примеры тестовых заданий и рекомендации к их выполнению1. При испытании веществ на электрическую проводимость лампочка загорится, если погрузить электроды в 1) водный раствор глюкозы
Анализ списка предложенных веществ позволяет выделить среди них единственное неорганическое соединение — щёлочь, что и обусловит выбор верного ответа. Ответ: 2. 2. Наиболее сильным электролитом является 1) раствор фтороводорода 3) сернистая кислота
Знание относительно силы бескислородных и кислородсодержащих кислот позволит найти правильный ответ. Ответ. 2. 3. К слабым электролитам относится каждое из двух веществ 1) хлороводород и гидроксид лития
Знание представителей группы слабых электролитов (или сильных электролитов) позволяет выбрать среди предложенных вариантов ответы 2 и 3 (пары предложенных в них веществ начинаются слабыми кислотами). Однако ответ 3 не подходит под условие задания, так как второе вещество предложенной пары является щёлочью. Ответ: 2. 4. В водном растворе ортофосфорной кислоты максимальной является концентрация 1) фосфат-ионов 3) гидрофосфат-ионов
На первый взгляд наиболее верным является ответ 2, так как трёхосновная фосфорная кислота диссоциирует преимущественно по первой из трёх возможных ступеней (число катионов водорода в этом случае также будет равно числу дигидрофосфат- ионов, и в этом случае ответ 4 также следует рассматривать как верный). Однако это не так. В результате диссоциации фосфорной кислоты по каждой из трёх ступеней образуются катионы водорода. Их суммарное число и будет максимальным среди всех ионов. Ответ: 4. 5. В качестве катионов только катионы водорода образуются при диссоциации вещества, формула которого 1) CHgCOONa 2) НСlO4 3) NH4Cl 4) NaHSO4 Следует учесть, что кислые соли сильных кислот (ответ 4) диссоциируют с образованием катионов металла, катионов водорода и анионов кислотного остатка. Ответ: 2. 6. Наибольшее (суммарное) число ионов образуется при диссоциации 1 моль 1) нитрата железа (III) 3) сульфата железа (III)
Для решения этого задания следует записать формулы предложенных солей. Наибольшее число ионов входит в состав сульфата железа (III). Ответ: 3. 7. Сокращённому ионному уравнению реакции
соответствует взаимодействие 1) оксида бария и серной кислоты
Все четыре варианта в качестве источника сульфат-иона предлагают серную кислоту, что отвечает сокращённому ионному уравнению реакции. Следовательно, необходимо анализировать первые вещества каждого из ответов. Катионы бария содержат его соли (ответы 3 и 4), однако ионы в растворе образуются при диссоциации растворимых солей. Ответ: 4. 8. Сокращённому ионному уравнению
соответствует взаимодействие между 1) гидроксидом железа (III) и соляной кислотой
Ионы Fe3+ образуют растворимые соли железа (III). Поле для выбора сужено до ответов 3 и 4. Оба взаимодействия возможны для указанных в условии задания ионов. Однако при взаимодействии сульфата железа (III) и гидроксида бария образуется не только осадок Fe(OH)3, но и осадок BaSO4, т. е. ионное уравнение не будет отвечать заданному. Ответ: 4. 9. Сокращённому ионному уравнению
соответствует взаимодействие между 1) гидроксидом цинка и соляной кислотой
Приведённое в условии задания сокращённое ионное уравнение соответствует взаимодействию между сильной кислотой и щёлочью с образованием растворимой соли. Ответ: 4. 10. Сокращённому ионному уравнению
соответствует взаимодействие между 1) медью и раствором сульфата железа (II)
Для нахождения верного ответа следует в качестве отправной точки использовать одну из исходных частиц в левой части ионного уравнения — Cu2+ или Fe. Если выбирается ион Си2+, то поле для выбора верного ответа сужается до 3 и 4. Анализ второй части предложенных пар позволяет выбрать верный ответ 3. Если же выбирается Fe, то поле выбора для верного ответа сужается до 2 и 3. Анализ второй части предложенных пар позволяет выбрать тот же верный ответ, так как предложенный в ответе 2 гидроксид меди (II) нерастворим. Ответ: 3.
1. К сильным электролитам относится кислота 1) угольная 2) серная 3) сернистая 4) фосфорная 2. Только сильные электролиты перечислены в ряду 1) гидроксид натрия, азотная кислота, хлорид магния
3. Наибольшее количество хлорид-ионов образуется при диссоциации 1 моль 1) соляной кислоты 3) хлорида цинка
4. Сокращённому ионному уравнению Cu2+ + 2OН- = Си(ОН)2 соответствует взаимодействие 1) нитрата меди (II) с гидроксидом магния
5. В качестве катионов только катионы водорода образуются при диссоциации вещества, формула которого 1)NH4NO3 2) CHgCOOH 3)KHSO4 4) NH4H2PO4 6. Наибольшее число ионов в растворе образуется при диссоциации 1 моль 1) хлорида железа (III) 3) нитрата цинка
7. Взаимодействию гидроксида железа (III) с соляной кислотой соответствует ионная реакция 1) Fe(OH)3 + ЗН+ = Fe3+ + 3H2O
8. Ионному уравнению Са2+ + 2OН- + СO2 = СаСO3 + Н2O соответствует взаимодействие 1) раствора гидроксида кальция с угарным газом
9. Осадок образуется при сливании водных растворов 1) гидроксида натрия и хлорида лития
10. Выделение газа происходит при взаимодействии веществ, формулы которых 1) ВаСO3 и НСl 3) СиО и H2SO4
Диссоциация электролитов в водных растворах. Ионные уравнения реакций. Ответы
|
|
|