|
|
|
|
|
Глава 2. Растворы. Теория электролитической диссоциации Кислоты как электролиты
Чем обусловлены общие свойства кислот? Какие группы кислот вам известны? Рассмотрим в свете теории электролитической диссоциации свойства веществ, растворы которых обладают электропроводностью.
По признаку осно́вности кислоты подразделяются на три группы:
Диссоциация многооснбвных кислот протекает ступенчато. Рассмотрим пример реакции электролитической диссоциации. Диссоциация серной кислоты протекает по двум ступеням:
В наибольшей степени диссоциация протекает по первой ступени и значительно меньше по второй. Среди кислот есть сильные и слабые электролиты, а их диссоциация протекает преимущественно по I ступени. Сильные кислоты диссоциируют в водных растворах практически нацело. Важнейшие общие химические свойства кислот1. Кислоты взаимодействуют с металлами. При этом образуются соли и выделяется водород. Однако металлы, стоящие в электрохимическом ряду напряжений металлов правее водорода, не вытесняют его из кислот:
HNO3 (как концентрированная, так и разбавленная), концентрированная H2SO4 реагируют с металлами иначе! 2. Кислоты взаимодействуют с осно́вными и амфотерными оксидами:
При избытке кислот образуются кислые соли: MgO + 2H2SO4 (изб.) = Mg(HSO4)2 + Н2O 3. Взаимодействие кислот с основаниями является реакцией нейтрализации:
4. Кислоты взаимодействуют с солями:
Для протекания реакции необходимо выполнение одного из следующих условий: а) кислота должна быть более сильной, чем та, что образовала соль;
Основные понятия Ион гидроксония • Основность кислот • Сильные кислоты • Слабые кислоты Вопросы и задания
|
|
|



 Какие общие свойства кислот вы знаете?
Какие общие свойства кислот вы знаете?
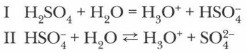
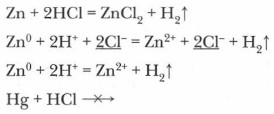
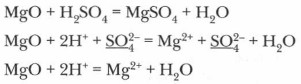
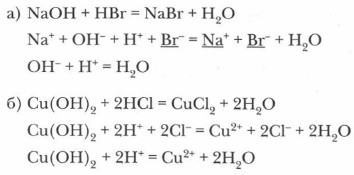
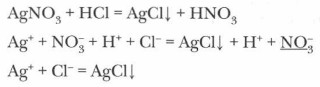
 1. Почему безводные кислоты слабо проводят электрический ток?
1. Почему безводные кислоты слабо проводят электрический ток?
 2. Какая соль образуется при взаимодействии 4 г едкого натра и 9,8 г фосфорной кислоты?
2. Какая соль образуется при взаимодействии 4 г едкого натра и 9,8 г фосфорной кислоты?