|
|
|
|
|
Глава 5. Углеводороды § 12. Химические свойства алканов и их применение (окончание)5. Реакция горения. При горении алканов выделяется большое количество теплоты (экзотермическая реакция), поэтому некоторые углеводороды используются в качестве топлива. Однако они горят по-разному, например, метан, этан, пропан, бутан сгорают полностью и горят бесцветным пламенем, а при горении гексана и гептана образуется много копоти.
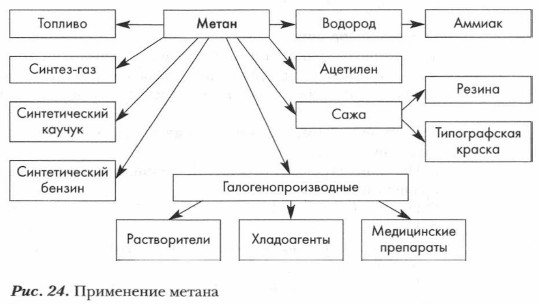
Помните — смесь метана с воздухом или кислородом взрывоопасна! Наиболее сильный взрыв происходит при смешивании метана с кислородом в соотношении 1: 2 или с десятью объемами воздуха (1:10). Такая смесь может образовываться в каменноугольных шахтах, в котельных, в жилых помещениях. Алканы широко используются как топливо и как сырье химической промышленности. Задание. Используя предложенный рисунок (рис. 24), расскажите о применении метана, основанном на его свойствах. Там, где возможно, запишите уравнения химических реакций.
В последние годы защита от разрушающего действия фреонов осуществляется благодаря ограничению их применения, производству фторсодержащих фреонов (например, 1,1,1,2-тетрафторэтана) и внедрению бесфреоновых технологий охлаждения. Получение алканов. С промышленными способами получения алканов мы будем знакомиться позже. Большой интерес вызывает лабораторный способ получения алканов — реакция Вюрца. Когда требуется увеличить в углеродной цепи число атомов углерода, используют эту реакцию. Под действием атомов металла из молекул галогенал- кана образуются два радикала, которые соединяются между собой и образуют новое вещество. Эту реакцию открыл французский ученый Ш.-А. Вюрц в 1855 г., и она носит его имя.
Основные понятия Парафины. Реакция радикального замещения (галогенирование, нитрование). Индуктивный эффект. Дегидрирование. Изомеризация. Крекинг. Реакция горения. Реакция Вюрца. Фреоны Вопросы и задания
С2Н6 → С2Н5Вr → С3Н8 → СО2.
|
|
|



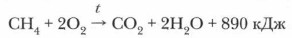
 Для биосферы большую опасность представляют галогенопроизводные метана и этана — фреоны, особенно хлор- и бромсодержащие. Они химически инертны, не горючи, не взрывоопасны, не токсичны, не растворимы в воде, а растворяются в органических растворителях. Благодаря этим свойствам фреоны используются как хладоагенты в промышленных и бытовых холодильниках, а также в системах автоматического пожаротушения. Однако, обладая высокой летучестью и попадая в атмосферу, фреоны разлагаются под действием ультрафиолетовых лучей с образованием различных соединений и радикалов типа Cl•, СlO•, ССl2•. Последние активно взаимодействуют с озоном, разрушают защитный озоновый слой атмосферы Земли.
Для биосферы большую опасность представляют галогенопроизводные метана и этана — фреоны, особенно хлор- и бромсодержащие. Они химически инертны, не горючи, не взрывоопасны, не токсичны, не растворимы в воде, а растворяются в органических растворителях. Благодаря этим свойствам фреоны используются как хладоагенты в промышленных и бытовых холодильниках, а также в системах автоматического пожаротушения. Однако, обладая высокой летучестью и попадая в атмосферу, фреоны разлагаются под действием ультрафиолетовых лучей с образованием различных соединений и радикалов типа Cl•, СlO•, ССl2•. Последние активно взаимодействуют с озоном, разрушают защитный озоновый слой атмосферы Земли.
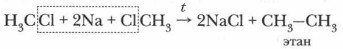
 1. Напишите уравнения химических реакций горения этана, пропана. Вычислите по уравнению в каждой реакции объем образовавшегося оксида углерода(IV) (н. у.), если прореагировало по 5 л алканов.
1. Напишите уравнения химических реакций горения этана, пропана. Вычислите по уравнению в каждой реакции объем образовавшегося оксида углерода(IV) (н. у.), если прореагировало по 5 л алканов.
 2. Составьте схему взаимодействия этана с хлором с указанием разрыва связи С—Н.
2. Составьте схему взаимодействия этана с хлором с указанием разрыва связи С—Н.
 8. Какие принимаются меры для защиты озонового слоя Земли?
8. Какие принимаются меры для защиты озонового слоя Земли?