|
|
|
|
|
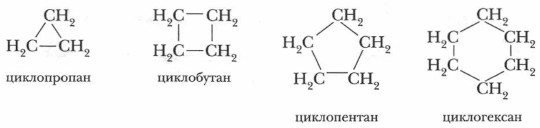
Глава 5. Углеводороды § 13. ЦиклоалканыК предельным углеводородам относится еще один класс органических соединений — циклоалканы (циклопарафины). Они имеют замкнутое строение. Общая формула циклоалканов — CnH2n. По размеру цикла циклоалканы делят на углеводороды с малым (С3— С4), средним (С5—С7) и большим (С8 и более) циклами. Их названия образуются добавлением приставки цикло- к названию соответствующего алкана:
Часто пользуются упрощенными графическими формулами:
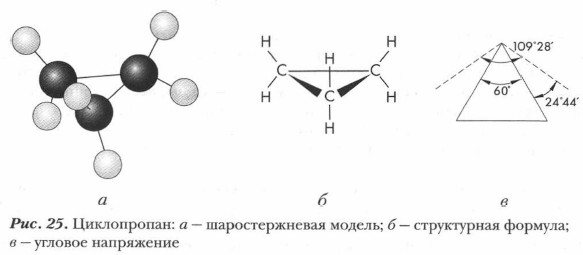
Особое положение среди циклоалканов занимает циклопропан. Он обнаруживает свойства, характерные для непредельных соединений, хотя и не вступает в такие типичные для них реакции, как окисление водным раствором перманганата калия и полимеризация. Это объясняется его пространственным строением. В обычных связях С—С (например, в случае алканов) sр3-орбитали перекрываются по прямой, соединяющей ядра атомов. В циклоалканах все атомы углерода тоже находятся в состоянии sр3-гибридизации, однако величина валентного угла в них отличается от 109°28'. В циклопропане (рис. 25) атомы углерода лежат в одной плоскости и образуют равносторонний треугольник с углами, равными 60°. Для замыкания цикла направления перекрывания орбиталей должны, казалось бы, отклониться от прямой на 24°44' При этом в молекуле возникнет такое внутреннее угловое напряжение, что цикл не будет устойчивым.
Если молекулы циклоалканов имеют несколько заместителей, то по правилам IUРАС учитывается алфавитный порядок заместителей:
|
|
|



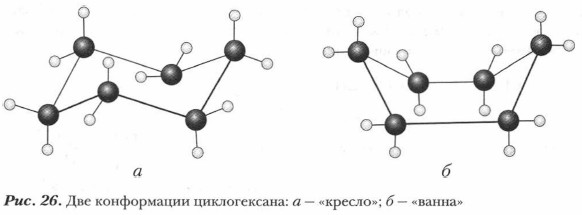
 В молекулах циклоалканов, состоящих из четырех, пяти или шести атомов углерода, внутреннее напряжение уменьшается другим способом. В отличие от трехчленного циклопропана, углеродные ядра в них не располагаются в одной плоскости и молекулы существуют в виде различных конформаций. Например, для молекулы циклогексана возможны две конформации — «кресло» и «ванна» (рис. 26). «Кресло» устойчивее «ванны». В конформации «кресло» валентные углы практически не деформированы, пространственные взаимодействия соседних СН2-групп незначительны (напряжение заслонения).
В молекулах циклоалканов, состоящих из четырех, пяти или шести атомов углерода, внутреннее напряжение уменьшается другим способом. В отличие от трехчленного циклопропана, углеродные ядра в них не располагаются в одной плоскости и молекулы существуют в виде различных конформаций. Например, для молекулы циклогексана возможны две конформации — «кресло» и «ванна» (рис. 26). «Кресло» устойчивее «ванны». В конформации «кресло» валентные углы практически не деформированы, пространственные взаимодействия соседних СН2-групп незначительны (напряжение заслонения).