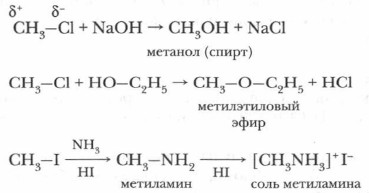|
|
|
|
|
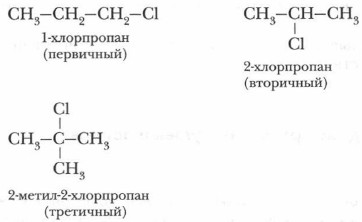
Глава 6. Галогенопроизводные углеводородов Галогенопроизводные предельных углеводородовГалогеналканы подразделяются на первичные, вторичные и третичные в зависимости от того, с каким атомом углерода связан галоген.
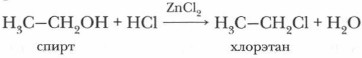
Получение галогеналкановГалогеналканы можно получить замещением атомов водорода в молекулах алканов (галогенирование), присоединением галогенов и галоге- новодородов (гидрогалогенирование) к молекулам алкенов, а также замещением гидроксильной группы в молекуле спирта на атом галогена, например при пропускании осушенного газообразного хлороводорода через этиловый спирт:
Задание. Составьте уравнения реакций хлорирования метана на свету, бромирования и гидробромирования этилена. Назовите полученные вещества. Физические и химические свойства галогеналканов
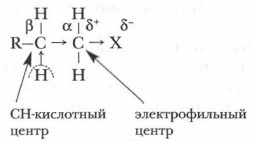
Физические свойства галогеналкановФизические свойства галогеноуглеводородов зависят от природы и числа атомов галогена в молекуле. Низшие и средние галогеналканы — бесцветные газы или жидкости со своеобразным сладковатым запахом. Многие из них обладают наркотическим действием. Температура кипения этих веществ с одинаковым углеводородным радикалом повышается с увеличением атомной массы галогена в ряду фторо-, хлоро-, бромо- и иодозамещенных. Высшие гомологи — бесцветные кристаллические вещества. Галогеноуглеводороды почти нерастворимы в воде, но очень легко растворяются в спиртах и других органических растворителях. Химические свойства галогеналкановРеакционная способность галогеноуглеводородов определяется характером связи углерод-галоген и структурой молекулы. Прочность связи углерод-галоген закономерно уменьшается при переходе от фтор- замещенных к иодзамащенным соединениям. Для реакционной способности важное значение имеет не только полярность, но и поляризуемость связи, т. е. легкость смещения электронного облака связи к галогену, который проявляет отрицательный (-I) индуктивный эффект. Наличие в молекуле электроотрицательного атома галогена приводит к перераспределению электронной плотности, в результате чего возникают два реакционных центра:
Галогенопроизводные вступают в реакции замещения и отщепления. 1. Реакции нуклеофильного замещенияПоляризация связи С—X способствует замещению атома галогена на нуклеофильный реагент (—ОН, —NH2; молекулы, содержащие неподеленные электронные пары:
С помощью реакций нуклеофильного замещения можно перейти от галогенопроизводных ко многим классам органических соединений.
|
|
|



 Повторите понятия: полярность связи, поляризуемость связи, индуктивный эффект.
Повторите понятия: полярность связи, поляризуемость связи, индуктивный эффект.
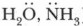 )
)