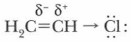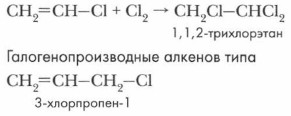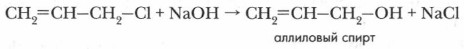|
|
|
|
|
Дополнительный материал к главе 6 ГалогеналкеныГалогеналкены — это производные алкенов, в молекулах которых один или несколько атомов водорода замещены на атомы галогенов. Изомерия у галогеналкенов зависит от строения углеродной цепи, а также от положения в ней двойной связи и атома галогена. У галогеналкенов нумеруются атомы углерода, начиная с того конца, где ближе стоит двойная связь:
Рассмотрим строение галогеналкенов на примере хлорэтена СН2=СН—Сl. В его молекуле происходит взаимодействие между свободными электронными парами атома галогена и π-электронной системой двойной связи. В результате этого взаимодействия под влиянием положительного мезомерного эффекта (+М-эффект) электроны атома галогена несколько смещены в сторону двойной связи. Одновременно, обладая отрицательным индуктивным эффектом (-I-эффект), атом галогена оттягивает электронную плотность с соседних связей в свою сторону:
Здесь действуют два эффекта (-I) и (+М) в двух противоположных направлениях. В результате связь С—Сl становится довольно прочной. Для этих веществ характерны реакции присоединения. Напишем уравнение реакции хлорирования хлорэтена:
ведут себя как обычные галогеноалканы й для них характерны реакции нуклеофильного замещения:
Галогенопроизводные алкенов получили широкое распространение и применение. Например, трихлорэтилен СНСl=ССl2 — бесцветная тяжелая жидкость с запахом хлороформа. Негорюч. Хороший растворитель жиров, масел, смол, применяется для химической чистки одежды. Хлорэтен СН2=СНСl — бесцветный токсичный газ. Легко полимеризуется с образованием поливинилхлорида. Тетрафторэтилен CF2=CF2 — бесцветный газ. Легко полимеризуется с образованием политетрафторэтилена (тефлона). Тефлон устойчив к действию практически всех агрессивных веществ. Выдерживает температуру от -70 до +250 °С. С применением этих веществ вы подробно ознакомитесь позже.
|
|
|