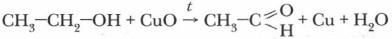|
|
|
|
|
Глава 7. Спирты, фенолы Химические свойства одноатомных спиртовНапример, если спирт нагревать в присутствии концентрированной серной кислоты, происходит внутримолекулярная дегидратация, при которой молекула спирта теряет молекулу воды и превращается в соответствующий алкен. Реакция ведется при температуре свыше 140 °С. С реакцией дегидратации спирта (внутримолекулярной) вы уже познакомились при изучении темы «Непредельные углеводороды», выполняя лабораторный опыт по получению этилена (см. § 15, практическая работа № 1). Если реакцию дегидратации спирта проводить при более низкой температуре (ниже 140 °С), молекула воды отщепляется уже не от одной молекулы спирта, а от двух, и основным продуктом такой реакции будет простой эфир. В приведенном выше примере продуктом реакции является диэтиловый эфир. Простые эфиры рассматривают как производные спиртов, у которых атом водорода гидроксильной группы замещен на углеводородный радикал. Их состав выражают формулой R—О—R. Простые эфиры — летучие жидкости с характерным запахом. В силу особенностей их строения образование водородных связей между молекулами простых эфиров затруднено. Поэтому в воде они малорастворимы. Температура кипения этих соединений значительно ниже, чем спиртов. Простые эфиры химически сравнительно малоактивны. Простые эфиры используют также для извлечения (экстрагирования) некоторых веществ из растений. Простые эфиры нельзя хранить в открытых сосудах и на свету.
При каталитическом окислении спиртов образуются альдегиды, следовательно, его можно рассматривать и как один из способов получения альдегидов. Используя это химическое свойство спиртов, мы получим из этилового спирта важный продукт — уксусный альдегид (ацетальдегид).
В этой реакции окисления роль катализатора играет медь: при нагревании медь окисляется кислородом воздуха в оксид, а затем, по ходу реакции, отдает этот кислород на процесс окисления спирта. Каталитическое окисление спиртов используется в качестве промышленного способа получения альдегидов. Этот процесс идет и в организме человека в случае попадания в него спирта. Спирты вступают в реакции и с веществами других классов органических соединений, но об этом вы узнаете немного позже. Получение и применение предельных одноатомных спиртовПромышленное получение тех или иных веществ связано с их значением в жизни человека, с широтой их применения и использования в качестве сырья для производства других нужных веществ и материалов. Наибольшее значение из предельных одноатомных спиртов имеют метанол и этанол. Метанол широко применяют для получения формальдегида, в качестве сырья при производстве важных для быта и техники пластмасс. Он используется как хороший растворитель лаков, политур, красителей. Из метанола синтезируют многие органические вещества. Спирты как производные углеводородов могут быть получены из них.
|
|
|



 Вам хорошо знаком диэтиловый эфир С2Н5—О—С2Н5, как продукт межмолекулярной дегидратации этилового спирта. Его применяют в медицине: в зубоврачебной практике его используют в качестве средства, осушающего полость рта. Раньше его применяли и в хирургии в качестве наркотического средства. Диэтиловый эфир — хороший растворитель жиров, смол, воска и других неполярных органических соединений, легко воспламеняется, поэтому при работе с ним нужно соблюдать меры предосторожности.
Вам хорошо знаком диэтиловый эфир С2Н5—О—С2Н5, как продукт межмолекулярной дегидратации этилового спирта. Его применяют в медицине: в зубоврачебной практике его используют в качестве средства, осушающего полость рта. Раньше его применяли и в хирургии в качестве наркотического средства. Диэтиловый эфир — хороший растворитель жиров, смол, воска и других неполярных органических соединений, легко воспламеняется, поэтому при работе с ним нужно соблюдать меры предосторожности.
 Лабораторный опыт. В пробирку налейте 1 см3 этилового спирта. Спираль из медной проволоки раскалите в пламени спиртовки или горелки до почернения. Какое вещество образовалось на поверхности меди? Нагретую медную спираль внесите в пробирку со спиртом (повторите опыт несколько раз). Понюхайте реакционную смесь после опыта. Соблюдайте правила техники безопасности. Как изменилась медная проволока после опыта? Какие выводы можно сделать из наблюдений? Запишите уравнение реакции:
Лабораторный опыт. В пробирку налейте 1 см3 этилового спирта. Спираль из медной проволоки раскалите в пламени спиртовки или горелки до почернения. Какое вещество образовалось на поверхности меди? Нагретую медную спираль внесите в пробирку со спиртом (повторите опыт несколько раз). Понюхайте реакционную смесь после опыта. Соблюдайте правила техники безопасности. Как изменилась медная проволока после опыта? Какие выводы можно сделать из наблюдений? Запишите уравнение реакции: