|
|
|
|
|
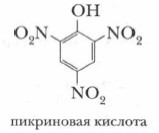
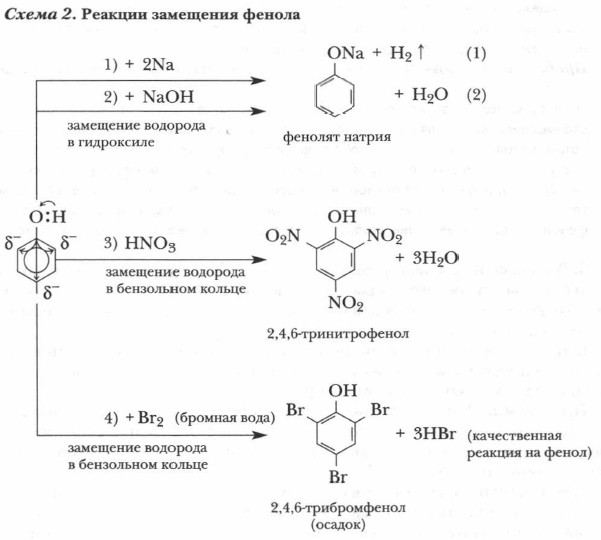
Глава 7. Спирты, фенолы § 26. Фенолы (окончание)4. В реакцию с фенолом могут вступать не только галогены. Аналогично и с большой легкостью протекает реакция фенола с азотной кислотой, где основным продуктом является 2,4,6-тринитрофенол, называемый пикриновой кислотой, — (NO2)3C6H2OH:
Пикриновая кислота служит основой производства взрывчатых веществ и красителей.
Итак, для фенола характерны реакции замещения (схема 2).
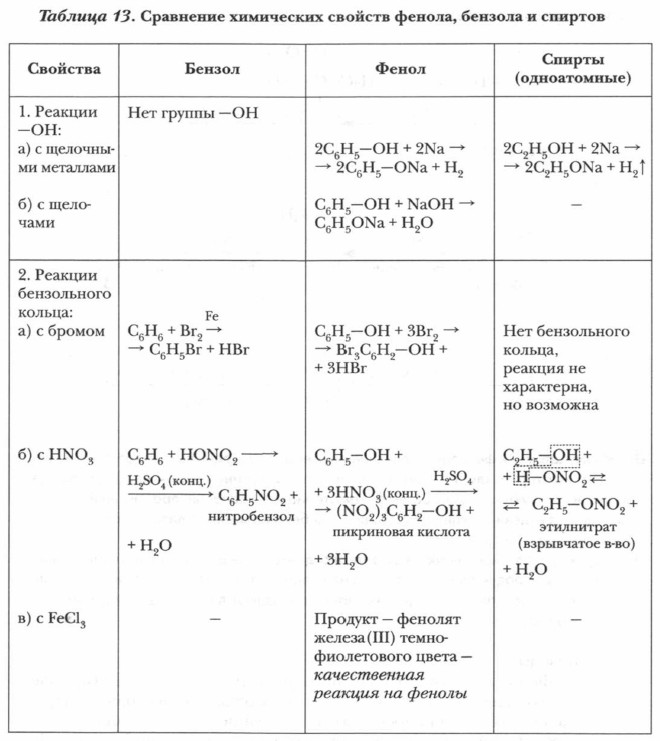
Обобщим наши наблюдения и знания о химических свойствах бензола в таблице 13.
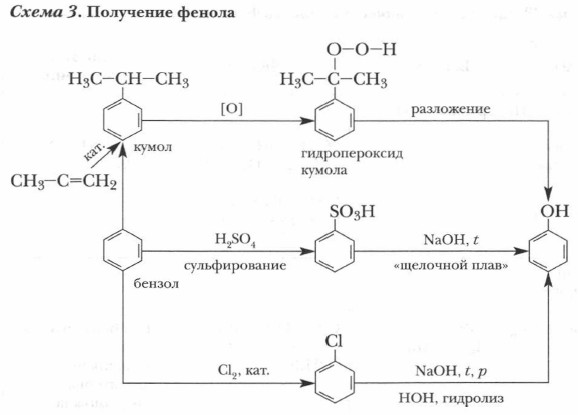
На примере фенола вы наглядно убедились в реальности учения о взаимном влиянии атомов в молекулах, разработанного А.М. Бутлеровым. Получение и применение феноловФенолы выделяют из каменноугольной смолы, из продуктов переработки бурого угля, торфа и древесины. Их получают также синтезом из бензола и его производных (см. схему 3).
Современной является технология комплексного получения фенола и ацетона из бензола и пропилена. Фенол чрезвычайно опасен для животных и растений. Поэтому при производстве и использовании фенола особое внимание уделяют экологическим проблемам, связанным с защитой природы от промышленных отходов, содержащих фенол. Фенол в больших количествах используется для производства красителей, фенолформальдегидных пластмасс, лекарственных веществ. В медицине для дезинфекции помещений и мебели применяют лизол, в состав которого входят разные фенолы.
Некоторые фенолы используют как антиоксиданты — вещества, предотвращающие порчу пищевых продуктов при их долгом или неправильном хранении (жиров, масел, пищевых концентратов и др.). Антиоксиданты добавляют в некоторые пищевые приправы и продукты.
Выводы 1. Фенолы — производные ароматических углеводородов (прежде всего бензола), в молекулах которых одна или несколько гидроксильных групп непосредственно соединены с атомами углерода ароматического (бензольного) кольца. Простейший и важнейший представитель — фенол. 2. Фенол ядовит! Его химические свойства обусловлены как функциональной группой —ОН, так и углеводородным ароматическим радикалом — фенилом (С 6 Н 5 —). На свойствах фенола сказывается взаимное влияние гидроксильной группы и бензольного ядра: в отличие от спиртов, он способен взаимодействовать как слабая кислота со щелочами, в отличие от бензола, в реакциях замещения атомов водорода бензольного кольца фенол образует 2,4,6-производные (трибромфенол, тринитрофенол и др.). 3. Фенолы находят широкое применение в медицине как антисептические и дезинфицирующие средства, в пищевой промышленности как антиоксиданты и в химическом производстве в качестве сырья для производства пластмасс, лекарств. Основные понятия Фенолы. Фенил. Строение молекулы фенола. Взаимное влияние радикала и функциональной группы. Особенности проявления химических свойств. Антиоксиданты. Токсичность фенолов и экология окружающей среды Вопросы и задания
|
|
|



 Из двухатомных фенолов в медицине применяют резорцин как антисептик и вещество для некоторых клинических анализов, а гидрохинон и другие двухатомные фенолы используют при обработке фотоматериалов в качестве проявителей.
Из двухатомных фенолов в медицине применяют резорцин как антисептик и вещество для некоторых клинических анализов, а гидрохинон и другие двухатомные фенолы используют при обработке фотоматериалов в качестве проявителей.
 1. Какие соединения называются фенолами и в чем их отличие от ароматических спиртов?
1. Какие соединения называются фенолами и в чем их отличие от ароматических спиртов?
 2. Напишите структурную формулу фенола и покажите смещение электронной плотности в молекуле.
2. Напишите структурную формулу фенола и покажите смещение электронной плотности в молекуле.
 3. Чем обусловлены кислотные свойства фенола и почему они выражены сильнее, чем у спиртов?
3. Чем обусловлены кислотные свойства фенола и почему они выражены сильнее, чем у спиртов?
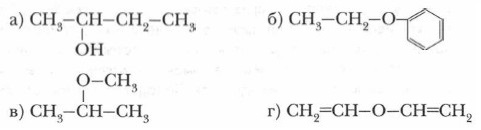
 9. Конкретизируйте схему 3 (с. 170) и укажите условия протекания реакций.
9. Конкретизируйте схему 3 (с. 170) и укажите условия протекания реакций.