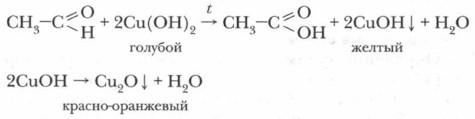|
|
|
|
|
Глава 8. Альдегиды и кетоны § 28. Химические свойства альдегидов
Химические свойства альдегидов, как и других соединений, обусловлены их строением и, прежде всего, их наиболее реакционноспособными химическими связями. Таковыми являются химические связи атомов функциональной группы. Химические свойства альдегиды могут проявлять и за счет углеводородного радикала, который испытывает определенное влияние функциональной группы. Химические свойства проявляются в химических реакциях. Поскольку важнейшей химической закономерностью является зависимость химических свойств соединения от его строения, еще раз обратимся к особенностям химического и электронного строения молекул альдегидов. Наиболее реакционноспособными в альдегидах являются связь между атомом углерода и водорода С—Н и π-связь в альдегидной группе Проблема. Опираясь на свои знания о строении альдегидов, предскажите возможные для них типы химических реакций. Альдегиды вступают в реакции разного типа. Но прежде всего это реакции, обусловленные наличием альдегидной группы. Вместе с тем альдегидная группа влияет на углеводородный радикал, делая некоторые его атомы водорода более подвижными. Рассмотрим наиболее типичные реакции альдегидов. 1. Реакции окисления альдегидовДля альдегидов характерны реакции окисления, причем альдегиы окисляются легче, чем спирты. Реакции осуществляются по месту связи С—Н альдегидной группы. Схема реакции окисления:
В качестве окислителей можно использовать K2Cr2C7 в кислой среде, оксиды и гидроксиды меди, серебра. Окислять альдегиды могут даже слабые окислители — оксиды и гидроксиды тяжелых металлов.
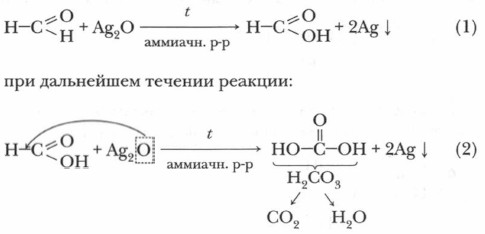
1. Окисление формальдегида аммиачным раствором оксида серебра (см. ссылку на с. 112). В чистую пробирку (держите ее вертикально!) внесите 5 капель раствора формальдегида. Прибавьте к ним 5 капель аммиачного раствора оксида серебра и слегка нагрейте на спиртовке (соблюдая правила нагревания жидкостей). Что наблюдаете? Образуется блестящее «зеркало». Как только оно получилось, нагревание прекратите. Содержимое пробирки слейте в специальную емкость, пробирки с «зеркалом» положите в специальном месте, указанном учителем (остатки серебра пойдут на переработку). Реакция «серебряного зеркала» является характерной, или качественной, реакцией на альдегиды. Запишем уравнение реакции:
Реакция «серебряного зеркала» требует соблюдения особых условий: чистые, хорошо вымытые пробирки и выдержанная концентрация необходимых растворов. В этом случае на стенках пробирки ровно оседает серебро, образуя зеркальный налет. В этой реакции формальдегид окисляется в угольную кислоту, а оксид серебра (I) восстанавливается до чистого металла — серебра. 2. Реакция ацетальдегида с гидроксидом меди(II). В чистую пробирку прилейте к сульфату меди (II) около 1 мл раствора гидроксида натрия (щелочь должна быть в избытке). Наблюдайте, что образовалось и какого цвета. Образовался нерастворимый осадок гидроксида меди (II) голубого цвета. К нему прибавьте 0,5 мл раствора ацетальдегида, пробирку взбалтывайте до образования светло-синего раствора. Смесь слабо нагрейте. Как изменяется окраска раствора? Вначале можно заметить образование желтого осадка гидроксида меди(I) СuОН, который затем превращается в красный осадок. Это Сu2O.
Эта реакция используется в медицинских биохимических лабораториях для обнаружения альдегидов при анализах на сахар в крови и моче.
|
|
|



 От чего зависят химические свойства веществ?
От чего зависят химические свойства веществ?
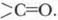
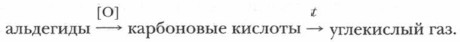
 Лабораторный опыты
Лабораторный опыты