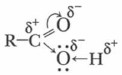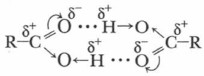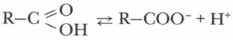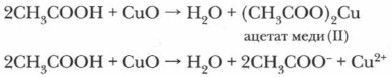|
|
|
|
|
Глава 9. Карбоновые кислоты и сложные эфиры Одноосновные насыщенные карбоновые кислотыВ карбонильной и гидроксильной группах, образующих карбоксильную группу, все связи полярны. Объясним подвижность водородного атома в карбоксильной группе. В карбонильной группе электронная плотность смещена от атома углерода к атому кислорода, поэтому на карбонильном углероде возникает частичный положительный заряд. Атом углерода, компенсируя этот положительный заряд, притягивает к себе неподеленную пару электронов атома кислорода гидроксильной группы. В свою очередь, атом кислорода оттягивает на себя электронную плотность связи О—Н. В результате атом водорода приобретает повышенную подвижность, что существенно упрощает его отрыв в виде протона.
Усиление полярности связи в гидроксильной группе кислот определяет их способность к образованию более прочных, чем у спиртов, водородных связей. Экспериментальные исследования по определению молекулярных масс жидких карбоновых кислот показали, что они состоят из димеров — удвоенных молекул, образованных водородными связями:
Было обнаружено, что даже в парах уксусной кислоты содержится смесь единичных молекул и димеров, а пары муравьиной кислоты образованы исключительно димерами. Энергия каждой водородной связи в димерах составляет около 7 кДж/моль. Следовательно, относительно высокие температуры кипения, а также и растворимость в воде первых гомологов рассматриваемого ряда карбоновых кислот объясняется их способностью к образованию водородных связей. Химические свойства карбоновых кислотХимические свойства карбоновых кислот обусловлены в первую очередь вышерассмотренными особенностями их строения. 1. Растворимые кислоты диссоциируют в воде
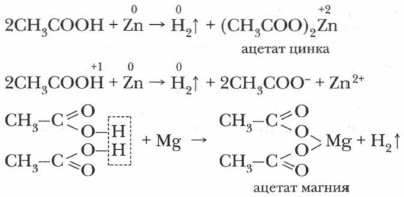
Благодаря наличию в воде иона Н+ они имеют кислый вкус, способны изменять окраску индикаторов и проводить электрический ток. В водном растворе эти кислоты — слабые электролиты. С увеличением углеводородного радикала снижается степень диссоциации и сила кислот в разбавленных растворах. 2. Карбоновые кислоты (особенно растворимые в воде) обладают химическими свойствами, характерными для растворов неорганических кислот, т. е. взаимодействуют с металлами, их оксидами, гидроксидами и слабыми солями. а) Взаимодействие с металлами (активными и среднеактивными) с образованием солей:
б) Взаимодействие с оксидами металлов:
в) Взаимодействие со щелочами: R—COOH + КОН → R—COOK + Н2O
г) Взаимодействие с солями слабых кислот: 2СН3СООН + NaHCO3 → CH3COONa + Н2O + CO2↑
Задание. Запишите тривиальное название гидрокарбоната натрия. Что вам известно о практическом применении реакции, уравнение которой (г) приведено выше? Как вы полагаете, подвергаются ли соли карбоновых кислот гидролизу? Почему?
|
|
|