|
|
|
|
|
Глава 9. Карбоновые кислоты и сложные эфиры Отдельные представители одноосновных предельных карбоновых кислот. МылаУксусная кислотаУксусная кислота (рис. 45, б )по объему производства и широте применения занимает ведущее место среди прочих органических кислот. Сегодня основным способом ее изготовления является каталитическое окисление углеводородов, например бутана:
Водный раствор (70-80 %-й) кислоты называется уксусной эссенцией, а 3-9 %-й водный раствор — столовым уксусом. Эссенция нередко используется для получения уксуса в домашних условиях путем разведения. Следует знать, что эссенция требует большой аккуратности при использовании, поскольку вызывает серьезные ожоги кожи и слизистых оболочек. Но большую часть уксусной кислоты синтезируют из других видов сырья.
В промышленности уксусную кислоту для технических целей получают каталитическим окислением бутана кислородом воздуха.
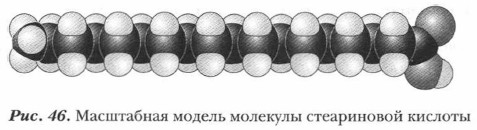
Масляная кислотаМасляная кислота содержится в коровьем масле в составе сложных эфиров, обладает резким, очень неприятным запахом. Пальмитиновая или стеариновая кислотыПальмитиновая (СН3— (СН2)14СООН, или С15Н31СООН) и стеариновая (СН3—(СН2)16СООН, или С17Н35СООН) кислоты (рис. 46) представляют собой наиболее распространенные в природе высшие предельные (жирные) карбоновые кислоты. Их природным источником служат жиры. Так, пальмитиновую кислоту получают из пальмового масла, содержащегося в плодах кокосового ореха (масло содержит до 35-40% пальмитиновой кислоты). Название стеариновой кислоты происходит от греч. stear— «сало», «жир».
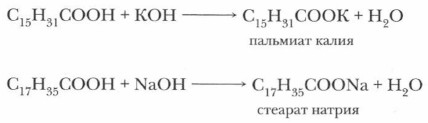
По физическим свойствам — это нерастворимые в воде твердые вещества белого цвета, жирные на ощупь, взаимодействующие с водными растворами щелочей и карбонатов с образованием солей:
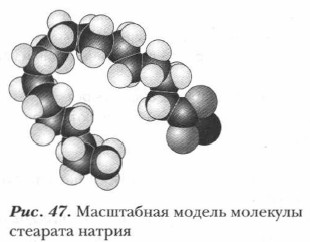
Натриевые и калиевые соли (рис. 47) высших жирных кислот (преимущественно стеариновой и пальмитиновой) хорошо растворяются в воде, обладают моющим действием и составляют основу твердого (натриевые соли) или жидкого (калиевые соли) мыла. Именно поэтому эти соли и называют мылами.
|
|
|



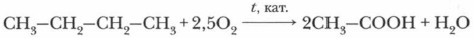
 Уксусная кислота образуется при брожении с доступом воздуха спиртосодержащих жидкостей (виноградного вина). Под действием фермента бактерий («уксусного грибка») происходит окисление спирта. В виде водных растворов эта кислота известна человеку с доисторических времен. Концентрированную кислоту путем перегонки винного и древесного уксуса впервые в 1537 г. получил немецкий естествоиспытатель Парацельс. При охлаждении ниже 17°С чистая кислота превращается в бесцветную кристаллическую массу, похожую на лед (ледяная уксусная кислота). При комнатной температуре остается бесцветной прозрачной жидкостью с невысокой вязкостью, примерно в 20 раз ниже, чем у серной кислоты (молекулы уксусной кислоты не связаны в единый пространственный каркас, как это имеет место у серной, но объединены водородными связями в устойчивые димеры, распадающиеся при нагревании выше 250 °С).
Уксусная кислота образуется при брожении с доступом воздуха спиртосодержащих жидкостей (виноградного вина). Под действием фермента бактерий («уксусного грибка») происходит окисление спирта. В виде водных растворов эта кислота известна человеку с доисторических времен. Концентрированную кислоту путем перегонки винного и древесного уксуса впервые в 1537 г. получил немецкий естествоиспытатель Парацельс. При охлаждении ниже 17°С чистая кислота превращается в бесцветную кристаллическую массу, похожую на лед (ледяная уксусная кислота). При комнатной температуре остается бесцветной прозрачной жидкостью с невысокой вязкостью, примерно в 20 раз ниже, чем у серной кислоты (молекулы уксусной кислоты не связаны в единый пространственный каркас, как это имеет место у серной, но объединены водородными связями в устойчивые димеры, распадающиеся при нагревании выше 250 °С).