|
|
|
|
|
Глава 13. Аминокислоты. Пептиды. Белки Классификация и пространственное строение белков
Задание. Вспомните, какова функция инсулина в организме человека. Определите, схема какого инсулина дана на рисунке 71. Вторичная структура белкаВторичная структура белковых молекул определяется возникновением внутри них множества водородных связей, которые способствуют свертыванию полипептидной цепи в спираль. В первую очередь водородные связи возникают между атомами кислорода и азота из рядом расположенных карбоксильных групп и аминогрупп. Это приводит к тому, что полипептидная цепь приобретает упорядоченное свертывание «остова». Исследовав различные виды ограничений вращения вокруг связей, американские ученые Л. Полинг и Р. Кори в 1950 г. доказали, что одним из наиболее выгодных расположений для полипептидной цепи является ее укладывание в форме спирали (рис. 73).
Во многих белках, особенно в глобулярных, часть, а в некоторых — большая часть, полипептидной цепи уложена в форме спирали.
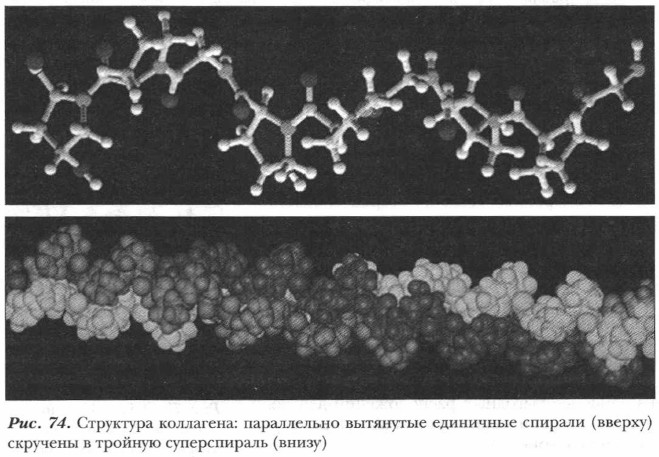
В фибриллярных белках образование водородных связей приводит к возникновению складчатой (листовой) структуры. Подобного типа структура возникает также в результате образования межмолекулярных водородных связей между разными параллельно расположенными цепями фибриллярного белка, например коллагена (рис. 74).
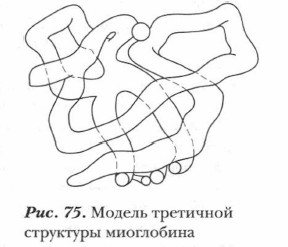
Третичная структура белкаТретичной структурой называется приобретаемая полипептидной цепью конфигурация в результате ее свертывания в пространстве (рис. 75). Формирование третичной структуры обусловлено наличием химических связей между различными участками полипептидной цепи. Такое «сшивание» цепи происходит в результате образования химических связей между атомами радикалов α-аминокислот и может иметь различную природу. Оно может быть обусловлено образованием:
|
|
|



 Инсулины человека и различных животных несколько отличаются друг от друга по составу. Эти отличия заключаются в изменениях на участке цепи А. Разными являются последовательности всего лишь трех аминокислот — с восьмой по десятую. Например, в молекулах инсулина человека имеется следующая последовательность: треонин — серин — изолейцин; в инсулине лошади: треонин — глицин — изолейцин, т. е. изменяется лишь один элемент цепочки; в инсулине быка все три аминокислоты этого участка иные: аланин — серин — валин.
Инсулины человека и различных животных несколько отличаются друг от друга по составу. Эти отличия заключаются в изменениях на участке цепи А. Разными являются последовательности всего лишь трех аминокислот — с восьмой по десятую. Например, в молекулах инсулина человека имеется следующая последовательность: треонин — серин — изолейцин; в инсулине лошади: треонин — глицин — изолейцин, т. е. изменяется лишь один элемент цепочки; в инсулине быка все три аминокислоты этого участка иные: аланин — серин — валин.