|
|
|
|
|
Глава 13. Аминокислоты. Пептиды. Белки § 49. Классификация и пространственное строение белков
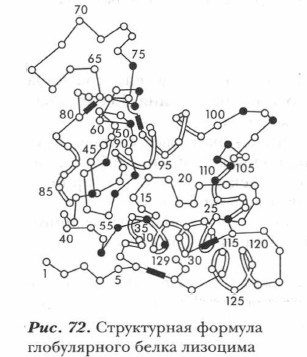
Классификация белковБелки исключительно многообразны. В основу их классификации могут быть положены состав, пространственное строение, биологическая функция и другие признаки. Состав белков. Белки подразделяются на простые и сложные. При гидролизе простых белков образуются не только аминокислоты, но и пептиды. Сложные белки наряду с полипептидными цепями содержат фрагменты небелковой природы. Важно подчеркнуть, что в живых организмах белки существуют обычно в составе сложных образований с высоким уровнем организации, включающих в качестве субъединиц различные небелковые биополимеры и другие группировки атомов. Например, в состав транспортных белков гемоглобина и мио- глобина наряду с белковой частью — глобином входит и небелковая — гем. Гем содержит ионы железа. Рассмотрим строение и структуру белков. Пространственное строение белковБелки подразделяются на два больших класса: глобулярные (от лат. globus — «шар») и фибриллярные (от лат. fibra — «волокно»). Глобулярные белкиГлобулярные белки (это, например, все биологические катализаторы — ферменты, антитела) имеют компактную структуру, напоминающую сферу. Белки-шарики растворимы в воде (рис. 72, 75).
Фибриллярные белкиФибриллярные белки имеют вытянутые в пространстве нитевидные структуры. Они нерастворимы в воде. Типичными представителями белков-нитей являются миоинозины (образуют мышечную ткань), кератины (содержатся в волосах, перьях, рогах и других производных кожи), коллагены (содержатся в коже, в соединительных тканях), эластины (образуют некоторые ткани легких, связок, артерий), фиброин шелка. Структура белковБелки обладают очень сложной структурой. Принято рассматривать четыре различных уровня организации структуры белков: первичную, вторичную, третичную и четвертичную структуры. Первичная структура белкаПервичная структура белка определяется последовательностью аминокислотных остатков в полипептидной цепи, связанных ковалентными (пептидными или амидными) связями. Как вы уже знаете, полипепгидная цепь имеет однообразное строение и представляет собой последовательное соединение пептидных групп через атомы углерода, соединенные с радикалами аминокислот. Таким образом, электронное и пространственное строение пептидной группы во многом определяет структуру полипептидной цепи в целом. Вы уже знакомы с последовательностью аминокислотных остатков в двух полипептидных цепях, образующих молекулу белка инсулина (см. рис. 71). Такой белок присутствует в организме всех млекопитающих.
|
|
|



 Все белки построены из 20 α-аминокислот. Как объяснить их исключительное многообразие?
Все белки построены из 20 α-аминокислот. Как объяснить их исключительное многообразие?