|
|
|
|
|
Глава 13. Аминокислоты. Пептиды. Белки § 49. Классификация и пространственное строение белков (окончание)Часть белков обладает и четвертичной структурой. Последняя имеет место в тех случаях, когда несколько одинаковых или сходных субъединиц соединяются в единое целое. В роли субъединиц выступают полипептидные цепи со свойственными им первичной, вторичной и третичной структурами. Субъединицы удерживаются рядом друг с другом посредством тех же взаимодействий, которые стабилизируют третичную структуру.
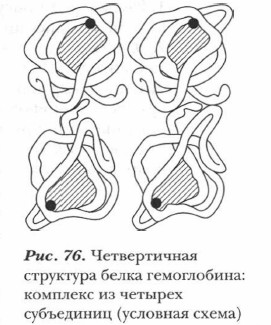
Классическими примерами белков, имеющих четвертичную структуру, являются гемоглобин и миоглобин. Частицы гемоглобина — белка, содержащегося в крови и отвечающего за транспортировку кислорода и диоксида углерода, — состоят из четырех субъединиц (рис. 76).
Гемоглобин — глобулярный белок крови, основной компонент красных кровяных клеток — эритроцитов. Главная его функция состоит в переносе кислорода из легких к тканям организма, а также в транспортировке услекислого газа.
Его четвертичная структура представляет собой устойчивое образование из четырех субъединиц. Каждая из них содержит полипептидную цепь из 141 аминокислотного остатка и гем — частицу небелковой природы, содержащую атом железа.
Лизоцим — глобулярный белок, содержащийся в слезной жидкости, слизистых выделениях человека, яичном белке и т. д. Макромолекула включает 1 29 аминокислотных остатков и имеет относительно небольшую молекулярную массу — 14 600. Лизоцим — фермент, расщепляющий связи молекул полисахаридов, образующих стенки клеток бактерий, поэтому его присутствие в тканях придает им бактерицидные свойства.
На поверхности макромолекулы лизоцима имеется впадина, точно соответствующая по размерам и химической природе фрагменту молекулы полисахарида. Когда такой фрагмент оказывается внутри этой «щели», примерно 20 аминокислотных остатков активного центра фермента окружают полисахаридный субстрат. При этом возникают новые химические связи, которые разрушают целостность субстрата. Это оказывает гибельное воздействие на бактериальные клетки.
Лизоцим был первым ферментом, исследованным в 1965 г. методом рентгеноструктурного анализа.
Коллаген — фибриллярный белок, содержащийся в подкожном слое, сухожилиях, хрящах, зубных и костных тканях. На долю белков группы коллагена приходится до 25% белкового вещества в организмах млекопитающих. Существует несколько типов коллагена, однако все они построены из трех полипептидных цепей, скрученных вместе в тройную спираль (см. рис. 74). Ковалентное «сшивание» имеет место как внутри тройной спирали, так и между соседними тройными спиралями.
Основные понятия Глобулярные, фибриллярные белки. Кератины. Коллагены. Первичная, вторичная, третичная, четвертичная структуры белка. Субъединица Вопросы и задания
|
|
|



 В глобулярных белках до половины аминокислотных остатков имеют гидрофобные (т. е. водоотталкивающие, в отличие от гидрофильных — притягивающих воду) аминокислотные радикалы (боковые цепи). Вследствие этого глобулярные белки в водных растворах проявляют тенденцию к свертыванию таким образом, чтобы гидрофобные боковые цепи сгруппировались внутри складок. При этом гидрофильные (полярные) боковые цепи оказываются на внешней поверхности молекулы. В результате обеспечивается вытеснение молекул воды из внутренней области белковой молекулы.
В глобулярных белках до половины аминокислотных остатков имеют гидрофобные (т. е. водоотталкивающие, в отличие от гидрофильных — притягивающих воду) аминокислотные радикалы (боковые цепи). Вследствие этого глобулярные белки в водных растворах проявляют тенденцию к свертыванию таким образом, чтобы гидрофобные боковые цепи сгруппировались внутри складок. При этом гидрофильные (полярные) боковые цепи оказываются на внешней поверхности молекулы. В результате обеспечивается вытеснение молекул воды из внутренней области белковой молекулы.
 1. Рассмотрите рисунок 71. Какова роль дисульфидных мостиков в структуре инсулина?
1. Рассмотрите рисунок 71. Какова роль дисульфидных мостиков в структуре инсулина?
 2. Эластины — белки, образующие некоторые ткани легких, связок, артерий. Какими физическими свойствами должны обладать белки этой группы (учтите характер их распространения)? Какие предположения относительно их структуры можно сделать?
2. Эластины — белки, образующие некоторые ткани легких, связок, артерий. Какими физическими свойствами должны обладать белки этой группы (учтите характер их распространения)? Какие предположения относительно их структуры можно сделать?
 3. Приведите примеры глобулярных и фибриллярных белков. Составьте сравнительную таблицу, отражающую их возможно более полные характеристики.
3. Приведите примеры глобулярных и фибриллярных белков. Составьте сравнительную таблицу, отражающую их возможно более полные характеристики.