|
|
|
|
|
Глава 3. Особенности строения и свойств органических соединений. Их классификация § 5. Электронное и пространственное строение органических соединений (окончание)Простая и кратная ковалентные связиСпособность атома углерода проявлять разные степени окисления в различных соединениях (от -4 до +4), sp3-; sp2-; sp-гибридизация позволяют атому углерода образовывать простые (одинарные) и кратные (двойные и тройные) связи не только с другими атомами углерода, но и с атомами других элементов-органогенов. В 9 классе вы уже рассматривали строение молекул этана, этилена и ацетилена и знаете, что в соединениях с двойной и тройной связью существуют два типа ковалентных связей: σ (сигма) и π (пи). Задание. Напишите структурные формулы этилена, этана и ацетилена. Вспомните схемы образования ковалентных связей в этих молекулах. Что представляют собой σ- и π-связи? Каковы особенности образования π-связи? Итак, между соединенными атомами в молекулах могут возникать одна, две и три ковалентные связи. Это особое свойство ковалентной связи называется кратностью связи.
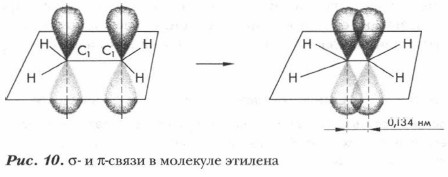
При образовании одной общей электронной пары между взаимодействующими атомами устанавливается простая, или одинарная, ковалентная связь, например в молекулах Н2, HF, F2, СН4, С2Н6 и др. При наличии у соединяемых атомов двух (O=O, Н2С=СН2, Н2С = O и др.) и трех (N≡N, НС≡СН и др.) общих электронных пар между ними возникает двойная или тройная связь — кратная связь. Как вы уже знаете, углеводороды с кратными связями называются непредельными, или ненасыщенными. С увеличением кратности связи всегда уменьшается ее длина и повышается прочность. 1. Простая ковалентная связь С—С или 2. Природа образования кратных углерод-углеродных связей иная, чем одинарных. В образовании двойной ковалентной связи С=С участвуют одна s- и две р-орбитали (это sр2-гибридизация, при которой образуются три гибридные орбитали, лежащие в одной плоскости под углом 120°). Одна р-орбиталь каждого атома углерода не участвует в гибридизации, но участвует в образовании второй углерод-углеродной связи. Негибридизированные р-орбитали располагаются перпендикулярно плоскости молекулы. Перекрываясь по обе стороны оси, негибридизированные р-орбитали образуют качественно новую ковалентную связь, менее прочную, чем σ-связь (рис. 10). Таким образом, одна из электронных пар в связи С=С осуществляет σ-связь, вторая — π-связь. Следовательно, двойная связь С=С представляет собой сочетание одной σ- и одной π-связей.
Тройная связь С≡С образуется одной σ- и двумя π-связями.
Например, в молекуле ацетилена у каждого из атомов углерода в гибридизации участвует одна s- и только одна р-орбиталь (sp-гибридизация). Образовавшиеся два sp-гибридных электронных облака атома углерода участвуют в формировании двух π-связей (с другим атомом углерода и атомом водорода). Облака двух других р-электронов каждого атома углерода в гибридизации участия не принимают. Сохраняя свою прежнюю конфигурацию (в виде гантели), они образуют две π-связи. Следовательно, в молекуле ацетилена три π-связи (одна С—С и две С—Н), направленные вдоль одной оси, и две π-связи С=С, расположенные в двух взаимно перпендикулярных плоскостях (рис. 11). σ-связи образуются негибридизированными р-электронами, сохраняющими форму объемной восьмерки, путем их перекрывания над и под плоскостью, в которой расположены σ-связи. Кратные (т. е. двойные и тройные) связи обладают высокой реакционной способностью и при реакциях легко переходят в простые.
Основные понятия Гибридизация атомных орбиталей: sp3-, sp2-, sp-гибридизация. Простая и кратная ковалентные связи Вопросы и задания
|
|
|



 В образовании простой и кратной ковалентных связей есть особенности.
В образовании простой и кратной ковалентных связей есть особенности.
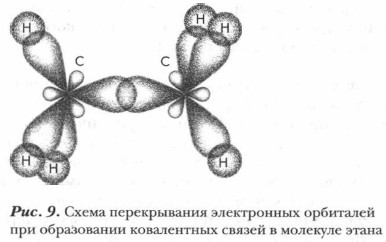
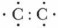 (например, в молекуле этана) образуется путем перекрывания двух sр3-орбиталей по линии, соединяющей центры связываемых атомов. Такая связь называется σ-связью. Чем больше объем перекрывания атомных орбиталей взаимодействующих атомов, тем прочнее связь (рис. 9).
(например, в молекуле этана) образуется путем перекрывания двух sр3-орбиталей по линии, соединяющей центры связываемых атомов. Такая связь называется σ-связью. Чем больше объем перекрывания атомных орбиталей взаимодействующих атомов, тем прочнее связь (рис. 9).
 1. Составьте молекулярную и электронную формулы этана и этилена.
1. Составьте молекулярную и электронную формулы этана и этилена.
 2. Составьте структурные и электронные формулы веществ, имеющих следующие углеродные цепи:
2. Составьте структурные и электронные формулы веществ, имеющих следующие углеродные цепи:
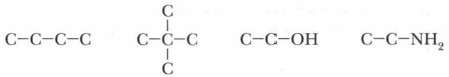
 3. В чем различие между σ- и π- связями в молекуле этилена?
3. В чем различие между σ- и π- связями в молекуле этилена?