|
|
|
|
|
Глава 3. Углеводороды § 12. Алкины (окончание)Окисление алкиновЭтин (ацетилен) горит в кислороде с выделением большого количества теплоты:
На этой реакции основано действие кислород-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более 3000 °С), что позволяет использовать её для резки и сварки металлов (рис. 23). На воздухе ацетилен горит коптящим пламенем, так как содержание углерода в его молекуле выше, чем в молекулах этана и этена. Алкины, как и алкены, обесцвечивают подкисленный раствор перманганата калия. При этом происходит разрушение кратной связи. Взаимодействие алкинов с основаниямиПри взаимодействии с сильными основаниями (например, амидом натрия) алкины, содержащие тройную связь на конце молекулы (т. е. атом водорода, присоединённый к атому углерода в sр-гибридизации), теряют катион водорода и образуют соли — ацетилениды:
Таким образом, можно сказать, что алкины проявляют свойства кислоты. Неподелённая электронная пара, находящаяся на гибридной орбитали атома углерода в состоянии sp-гибридизации, лучше удерживается ядром, чем в случае sр3-гибридизации, что приводит к более высокой кислотности алкинов. Способность находящегося при тройной связи атома водорода замещаться на металл применяют для отделения алкинов с тройной связью на конце молекулы от всех остальных алкинов:
Смесь алкинов пропускают через аммиачный раствор оксида серебра. Образовавшаяся соль выпадает в осадок. Её отфильтровывают и разлагают кислотой. Следует отметить, что соль серебра Способность ацетиленидов реагировать с галогенпроизводными используют для синтеза сложных соединений, содержащих тройную связь:
Применение алкиновАлкины являются сырьём для производства большого количества органических соединений и материалов: альдегидов, кетонов, растворителей (тетрагалогенэтанов), исходных веществ для получения синтетических каучуков, поливинилхлорида и других полимеров (рис. 24). Ацетилен — ценнейшее горючее с очень высокой теплотой горения.
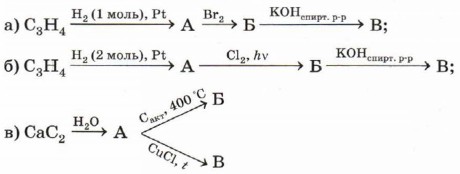
1. Возможна ли для алкинов цис-, транс-изомерия? 2. Напишите все возможные формулы изомеров углеводорода состава С5Н8, относящихся к классу алкинов. 3. Предложите способы получения ацетилена из неорганических веществ. Напишите уравнения соответствующих реакций. 4. Напишите уравнения реакций, при помощи которых можно осуществить превращения по схемам:
Назовите вещества А, Б и В. 5. С помощью каких реагентов и при каких условиях можно получить бутин-2 из бутена-2? Запишите уравнения реакций. 6. Почему в работах, связанных с использованием ацетилена, категорически запрещено применять оборудование, содержащее медь или её сплавы (в реакторах, инструментах, коммуникациях и т. д.)? 7. При пропускании 19,3 г смеси пропана, пропена и пропина через аммиачный раствор оксида серебра выпало 7,35 г осадка. При полном сгорании такого же количества исходной смеси образовалось 59,4 г углекислого газа (н. у.). Сколько граммов воды образовалось при этом?
8. 3,92 л (н. у.) смеси газообразных алкена и алкина, содержащих одинаковое число атомов углерода, могут присоединить 40 г брома. Образовавшаяся при этом смесь имеет массу 47,2 г. Определите строение алкена и алкина, а также объёмные доли углеводородов в исходной смеси. Ответ: 57,1% С3Н6, 42,9% С3Н4. 9. Составьте уравнения реакций гидрирования, хлорирования, гидробромирования, гидратации пропина. Сравните эти реакции с аналогичными для пропена. В чём специфика реакции гидратации алкина?
|
|
|






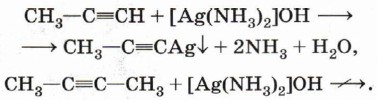
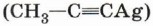 и подобные ей соединения меди взрывоопасны.
и подобные ей соединения меди взрывоопасны.