|
|
|
|
|
Глава третья. Вещества и их свойства § 23. Основания (окончание)Взаимодействие с солямиЭти химические реакции подчиняются общему правилу условий протекания реакций между электролитами — должны образоваться осадок, газ или малодиссо- циирующее вещество. Для получения осадка можно воспользоваться общим способом получения нерастворимых гидроксидов металлов — взаимодействием их солей с щелочами: FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl,
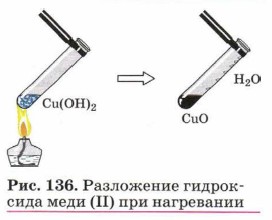
Нерастворимые гидроксиды, полученные реакциями обмена растворов солей с щелочами, показаны на рисунке 135.
Примером реакции между щёлочью и солью, идущей с образованием газа, может служить качественная реакция на соли аммония, т. е. на катион аммония: NH4Cl + КОН = КСl + NH3↑ + H2O,
Выделяющийся аммиак обнаруживают или по запаху, или по изменению цвета влажной лакмусовой бумажки с красного на синий, или по появлению белого дыма при поднесении палочки, смоченной концентрированной соляной кислотой. Разложение нерастворимых основанийПри нагревании нерастворимые основания и амфотерные гидроксиды разлагаются на соответствующий оксид металла и воду (рис. 136): Сu(ОН)2 = СuО + Н2O, 2Аl(ОН)3 = Аl2О3 + ЗН2O.
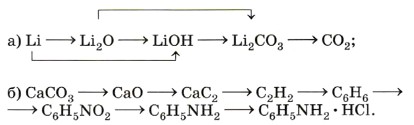
1. Дайте определение понятия «основания», исходя из их состава. 2. Дайте определение понятия «основания» с точки зрения теории электролитической диссоциации. 3. На какие группы делят основания по изученным вами признакам классификации этих веществ? 4. Исходя из изученных признаков классификации оснований, дайте полную характеристику гидроксида бария Ва(ОН)2 и анилина C6H5NH2. 5. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
6. В 200 мл воды растворили 48 г гидроксида натрия, содержащего 5% примесей. Найдите массовую долю щёлочи в полученном растворе. 7. При взаимодействии 585 г 20% -го раствора хлорида аммония с необходимым количеством гидроксида кальция было получено 33,6 л аммиака (н. у.). Сколько это составляет процентов от теоретически возможного? 8. Вычислите массу анилина, который можно получить реакцией Зинина из 930 кг нитробензола, если выход анилина составляет 85% от теоретически возможного. 9. В любой домашней и автомобильной аптечке обязательно содержится пузырёк или ампула с нашатырным спиртом — 10%-м раствором аммиака в воде. Сколько миллилитров газообразного аммиака (н. у.) и граммов воды содержится в одной ампуле, масса раствора нашатырного спирта в которой равна 2 г?
|
|
|