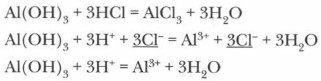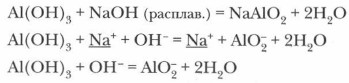|
|
|
|
|
Глава 2. Растворы. Теория электролитической диссоциации § 10. Основания как электролиты
В чем состоят их отличия по физическим и химическим свойствам? Какие основания известны человеку с глубокой древности? Какое применение они находили?
Общие свойства оснований обусловлены наличием в их составе гидроксо- групп. Число гидроксогрупп в составе основания определяет его кислотность. По признаку кислотности основания также делятся на три группы:
Двух- и трехкислотные основания диссоциируют ступенчато:
По особенностям химических свойств основания делят на три группы: растворимые, нерастворимые, амфотерные. Большинство оснований нерастворимо в воде. Наиболее сильными основаниями являются гидроксиды щелочных металлов — элементов главной подгруппы первой группы периодической системы. В отдельных случаях их называют едкими щелочами: едкий натр (гидроксид натрия), едкое кали (гидроксид калия). К едким щелочам относится и гидроксид бария. При попадании на кожу едкие щелочи могут вызвать сильные ожоги. К растворимым основаниям относится слабый электролит — гидрат аммиака NH3 • Н2O. Для нерастворимых гидроксидов характерны низкая способность к диссоциации и, соответственно, малые значения констант диссоциации.
В водном растворе они диссоциируют как кислоты (с образованием катиона Н+) или как щелочи (с образованием аниона ОН-) в зависимости от условий. В общем виде схему электролитической диссоциации амфотерного гидроксида можно выразить следующим образом:
или кислоты:
Согласно теории электролитической диссоциации общие свойства щелочных растворов — изменение цвета индикаторов, взаимодействие с кислотами, кислотными оксидами и солями, а также мылкость растворов на ощупь — обусловлены присутствием в них гидроксид-ионов. Наиболее общие химические свойства щелочей и нерастворимых оснований представлены в таблице 4.
|
|
|



 Какие группы оснований вам известны?
Какие группы оснований вам известны?
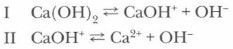
 Амфотерные гидроксиды способны вступать во взаимодействие как с кислотами, так и со щелочами.
Амфотерные гидроксиды способны вступать во взаимодействие как с кислотами, так и со щелочами.