|
|
|
|
|
Глава 6. Спирты, фенолы § 21. Фенолы
Правила ИЮПАК допускают наряду с международными названиями (например, фенол называется гидроксибензолом) использовать тривиальные, широко применяемые на практике: фенол, гидрохинон, резорцин и др.
Наиболее известный представитель этого класса соединений — фенол. Его формула С6Н5—ОН. Радикал фенола СбН5— называется фенил.
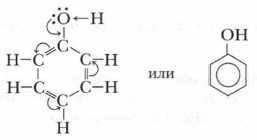
Особенности строения молекулы фенолаВспомните строение бензола, особенности связей и распределение электронной плотности в бензольном кольце. Если в бензоле один атом водорода заменить на группу —ОН, получим фенол.
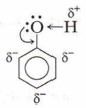
Гидроксильная группа в феноле непосредственно связана с атомом углерода радикала фенила и в отличие от спиртов проявляет донорные (кислотные) свойства. Фенил оказывает влияние на гидроксильную группу (поляризация связи О—Н), что повышает кислотные свойства фенола. В отличие от радикалов предельных углеводородов, являющихся донорами электронов, бензольное кольцо, точнее, радикал С6Н5—, называемый фенилом, обладает особенностью оттягивать к себе электроны, в данном случае — от атомов кислорода гидроксильной группы —ОН. Это приводит к поляризации, что делает атом водорода более подвижным, а вещество фенол приобретает слабые кислотные свойства. В свою очередь, гидроксильная группа оказывает влияние на радикал. Под влиянием функциональной группы —ОН в бензольном кольце фенола электронная плотность распределяется неравномерно: частичный отрицательный заряд сосредоточен у атомов углерода, находящихся в 2,4,6-положениях. Это облегчает реакции замещения атомов водорода бензольного кольца именно в указанных положениях. В результате реакций замещения получают 2,4,6-производные фенола.
На примере фенола хорошо прослеживается взаимное влияние атомов в молекуле, и в частности влияние функциональной группы и радикала друг на друга.
Физические свойства фенолаФенол — твёрдое, бесцветное, кристаллическое вещество, низконлавкое, очень гигроскопичное, с характерным резким запахом. На воздухе фенол окисляется, поэтому его кристаллы приобретают вначале розоватый оттенок, а при длительном хранении темнеют и становятся красноватыми. Он малорастворим в воде при комнатной температуре, но быстро и хорошо растворяется при 60-70 °С. Фенол легкоплавок, его температура плавления 43 °С. Фенол обладает антисептическими (обеззараживающими) свойствами. Токсичен! Водный 5 %-й раствор (слабая карболовая кислота, слабее, чем уксусная) не изменяет окраски лакмуса.
Химические свойства фенолаНаличие в молекуле фенола как гидроксильной группы, так и бензольного кольца в углеводородном радикале фениле обусловливает его химические свойства. Проблема. Опираясь на знание строения молекулы фенола и взаимного влияния атомов и групп атомов в его молекуле, предскажите возможные реакции, в которые он вступает. Наличие группы —ОН в молекуле делает некоторые его свойства схожими со свойствами спиртов. 1. Фенол реагирует с щелочными металлами.
2СбН5—ОН + 2Na → 2C6H5—ONa + Н2↑ 2. Фенол обладает слабыми, но более сильными, чем у одноатомных спиртов, кислотными свойствами. Вследствие этого и в отличие от одноатомных спиртов фенол реагирует, как и многоатомные спирты, со щелочами. Задание. Напишите уравнение реакции фенола с гидроксидом натрия, укажите её тип и условия протекания. Оборудование и реактивы: фенол кристаллический, 3%-й раствор фенола, бромная вода (6 капель брома на 50 мл воды), 10%-й раствор NaOH, 1 %-й раствор FeCl3, растворы лакмуса и фенолфталеина, 5 пробирок, спиртовка, микрошпатель.
При проведении всех опытов с фенолом будьте осторожны! Работы с фенолом возможны только в защитных очках или маске! Попадание фенола на кожу вызывает ожог!
После выполнения опытов содержимое всех пробирок не выливается в раковину, а сливается в специально приготовленную посуду. Пробирки хорошо промываются водой. После окончания работы необходимо тщательно вымыть руки.
Реакции с участием гидроксильной группы
1. В пробирку с помощью пипетки внесём 5 капель 10%-го раствора гидроксида натрия и 1 каплю фенолфталеина, раствор слабо окрасится в малиновый цвет. К раствору щёлочи добавим по каплям (до исчезновения окраски) водный раствор фенола. После добавления каждой капли раствора фенола пробирку с содержимым взбалтываем. Наблюдаем изменения внешнего вида раствора. Образуется фенолят натрия. 2. Полученный раствор фенолята натрия разделим на две части, отлив половину его в другую пробирку. В первую пробирку с фенолятом натрия добавим немного разбавленной соляной кислоты. Что вы наблюдаете? Через содержимое второй пробирки пропустим из аппарата Киппа углекислый газ. Что вы наблюдаете? Запишите уравнения произошедших реакций.
Реакции с участием бензольного кольца
1.В пробирку внесём 1 каплю раствора фенола и добавим по каплям бромную воду до появления белой взвеси, которая затем выпадает в осадок. Составьте уравнение реакции. Эта реакция служит для обнаружения (идентификации) фенола.
2. В пробирку внесём каплю раствора фенола и 5 капель воды. Добавим к содержимому пробирки 1-2 капли раствора хлорида железа (III). Наблюдаем изменение цвета раствора. Каков он? (Уравнение этой реакции писать не надо, в результате её образуется сложное комплексное соединение.) Данная реакция фенола с раствором FeCl3 является качественной реакцией на фенол.
Экспериментально установили, что фенол — химически активное вещество.
|
|
|



 Какие ароматические соединения вам известны? Изобразите формулу бензола и укажите особенности его строения. Какие реакции характерны для бензола? Запишите уравнения и укажите условия их протекания.
Какие ароматические соединения вам известны? Изобразите формулу бензола и укажите особенности его строения. Какие реакции характерны для бензола? Запишите уравнения и укажите условия их протекания.
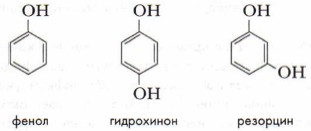
 В зависимости от числа функциональных групп фенолы делятся на одноатомные, двухатомные, трёхатомные и др. Приведём примеры.
В зависимости от числа функциональных групп фенолы делятся на одноатомные, двухатомные, трёхатомные и др. Приведём примеры.
 Демонстрационный опыт. В пробирку нальём 3 мл Н2O и добавим шпателем несколько кристалликов фенола. Смесь встряхнём. Раствор мутнеет, на дне пробирки остаются кристаллы. Пробирку слегка нагреем (до исчезновения кристаллов). Что вы наблюдаете? Почему раствор стал прозрачным? Затем содержимое пробирки охладим. Что вы наблюдаете? Сделайте выводы.
Демонстрационный опыт. В пробирку нальём 3 мл Н2O и добавим шпателем несколько кристалликов фенола. Смесь встряхнём. Раствор мутнеет, на дне пробирки остаются кристаллы. Пробирку слегка нагреем (до исчезновения кристаллов). Что вы наблюдаете? Почему раствор стал прозрачным? Затем содержимое пробирки охладим. Что вы наблюдаете? Сделайте выводы.