|
|
|
|
|
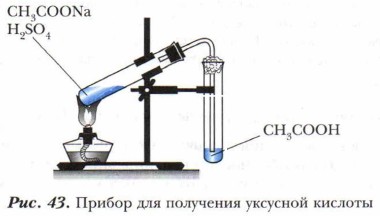
Глава 7. Альдегиды, кетоны, карбоновые кислоты и сложные эфиры Карбоновые кислотыПолучение карбоновых кислотКарбоновые кислоты в промышленности получают окислением предельных углеводородов, спиртов и альдегидов. В лаборатории уксусную кислоту получают путём нагревания ацетата натрия и раствора серной кислоты (рис. 43).
Задание. Рассмотрите рисунок 43. Какие вещества являются исходными для получения уксусной кислоты? Как связано со свойствами реагентов и продуктов реакции устройство прибора? Какие правила техники безопасности следует соблюдать при проведении этого опыта? Составьте уравнение реакции получения уксусной кислоты. Отдельные представители одноосно́вных предельных карбоновых кислот. Мыла
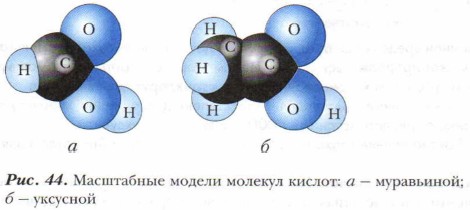
Муравьиная кислота (рис. 44, а) — едкая летучая жидкость с резким неприятным запахом, при попадании на кожу вызывает ожоги. С водой смешивается в любых соотношениях, однако в водном растворе данная кислота является весьма слабым электролитом. Почему?
Обратите внимание на состав и строение муравьиной кислоты Подобно альдегидам, муравьиная кислота является сильным восстановителем. Например, она восстанавливает серебро из аммиачного раствора оксида серебра (I):
Карбоксильная группа определяет свойства кислот, типичные для представителей данного гомологического ряда. Задание. Запишите уравнения реакций, характеризующих кислотные свойства муравьиной кислоты. Определите типы реакций.
Муравьиная кислота широко применяется для получения сложных эфиров, используемых в парфюмерии, в кожевенном деле (дубление кож), текстильной промышленности (как протрава при крашении), в качестве растворителя и консерванта. Уксусная кислота (рис. 44, б) в виде водных растворов известна человеку с доисторических времен. Концентрированную кислоту путём перегонки винного и древесного уксуса впервые в 1537 г. получил немецкий естествоиспытатель Парацельс. При охлаждении ниже 17 °С чистая кислота превращается в бесцветную кристаллическую массу, похожую на лёд (ледяная уксусная кислота). При комнатной температуре — бесцветная прозрачная жидкость. По объёму производства и широте применения уксусная кислота занимает ведущее место среди прочих органических кислот. Сегодня основным способом её изготовления является каталитическое окисление углеводородов, например бутана:
Водный раствор (70-80%) кислоты называется уксусной эссенцией, а 3-9%-й водный раствор — столовым уксусом. Эссенция нередко используется для получения уксуса в домашних условиях путём разведения. Следует знать, что эссенция требует большой аккуратности при использовании, поскольку вызывает серьёзные ожоги кожи и слизистых оболочек.
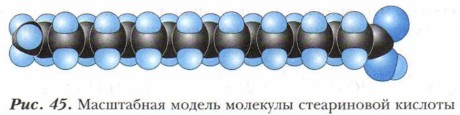
На протяжении столетий уксусную кислоту получали в результате процессов брожения. Этот способ используется и сегодня в производстве пищевого уксуса. В промышленности уксусную кислоту получают сухой перегонкой древесины. Но бо́льшую часть уксусной кислоты синтезируют из других видов сырья. Уксусную кислоту для технических целей получают каталитическим окислением бутана кислородом воздуха. Масляная кислота содержится в коровьем масле в составе сложных эфиров, обладает резким, очень неприятным запахом. Пальмитиновая С15Н31СООН и стеариновая С17Н35СООН кислоты (рис. 45) представляют собой наиболее распространённые в природе высшие предельные (жирные) карбоновые кислоты. Их природным источником служат жиры. Так, пальмитиновую кислоту получают из пальмового масла, содержащегося в плодах кокосового ореха (масло содержит до 35-40% пальмитиновой кислоты). Название стеариновой кислоты происходит от греч. stear — «сало», «жир».
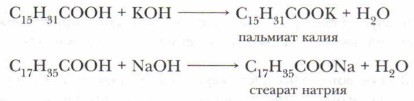
По физическим свойствам эти кислоты — нерастворимые в воде твёрдые вещества белого цвета, жирные на ощупь. Они взаимодействуют с водными растворами щелочей и карбонатов с образованием солей:
Мыла — это натриевые и калиевые соли жирных кислот.
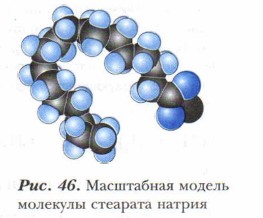
Натриевые и калиевые соли (рис. 46) высших жирных кислот (преимущественно стеариновой и пальмитиновой) хорошо растворяются в воде, обладают моющим действием и составляют основу твёрдого (натриевые соли) или жидкого (калиевые соли) мыла. Именно поэтому эти соли и называют мылами. Однако эти мыла плохо моют в жёсткой воде и имеют щелочной характер, что отрицательно влияет на кожу и некоторые ткани человека. Поэтому в настоящее время интенсивно развивается производство синтетических моющих средств (СМС) — стиральных порошков «Тайд», «Лоск» и других с хорошими моющими качествами даже при использовании в жёсткой воде, не оказывающих вредное воздействие на кожу; различного туалетного мыла с нейтральным pH и смягчающими компонентами и др. Карбоновые кислоты — слабые электролиты. Их соли, образованные слабой кислотой и сильным основанием, подвергаются гидролизу, водные растворы мыла имеют слабощелочную реакцию.
Проблема. Как известно, стирка с помощью мыла в жёсткой, и тем более морской воде сопряжена с некоторыми трудностями. Как это объяснить? Большое количество жирных кислот, необходимых для изготовления мыла, в современной промышленности получают из парафина. Для этого парафин плавят и в присутствии катализатора (например, соединений марганца) окисляют, создавая ток воздуха. В результате крупные молекулы углеводородов расщепляются в любой точке, а образующиеся при этом концевые метиленовые группы окисляются в карбоксильные:
В этом промышленном процессе образуется смесь различных кислот, которые подвергаются разделению. Далее синтетические кислоты превращают в соли и используют для получения различных сортов мыла.
Основными недостатками мыла являются щелочной характер раствора и то, что оно плохо моет в жёсткой воде. Поэтому в XX в. разработаны различные синтетические моющие средства (СМС), имеющие совершенно иную химическую природу.
Основные понятия Номенклатура • Гомологический ряд • Строение молекул • Карбоксильная группа • Муравьиная кислота • Уксусная кислота • Уксусная эссенция • Жирные кислоты • Мыла Вопросы и задания
Выводы 1. Карбоновые кислоты — это производные углеводородов, содержащие в своём составе одну или несколько карбоксильных групп, связанных с углеводородным радикалом. 2. Многообразие органических кислот обусловлено наличием разного числа карбоксильных групп, разной природой углеводородных радикалов (предельные, непредельные, ароматические и др.). 3. Органические кислоты очень широко распространены в природе и выполняют широкий спектр функций в клетках живых организмов — от источника энергии до строительного материала клеток. 4. Подавляющее число органических кислот (растворимых в воде) — слабые электролиты. 5. Наряду с общими химическими свойствами, присущими неорганическим кислотам, карбоновые кислоты проявляют специфические свойства, зависящие от углеводородного радикала, как следствие взаимного влияния атомов (и их групп) в молекуле. 6. Между классами кислородсодержащих соединений существует генетическая связь.
|
|
|



 Проанализируйте состав муравьиной кислоты. Какие особенности её строения должны существенно сказываться на химических свойствах этого соединения?
Проанализируйте состав муравьиной кислоты. Какие особенности её строения должны существенно сказываться на химических свойствах этого соединения?
 В старину раздражающее действие муравьиной кислоты использовали для лечения ревматизма и подагры. В современной медицине, а также в домашних условиях её применяют для растираний при ревматизме в виде 1 %-го спиртового раствора, который называют муравьиным спиртом (когда-то для его получения муравьёв настаивали на спирту), но чаще используют специальные медицинские препараты и процедуры.
В старину раздражающее действие муравьиной кислоты использовали для лечения ревматизма и подагры. В современной медицине, а также в домашних условиях её применяют для растираний при ревматизме в виде 1 %-го спиртового раствора, который называют муравьиным спиртом (когда-то для его получения муравьёв настаивали на спирту), но чаще используют специальные медицинские препараты и процедуры.
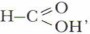 в молекуле которой можно «увидеть» в единстве две функциональные группы: альдегидную и карбоксильную. Эта особенность строения определяет двойственность её химических свойств, т. е. позволяют рассматривать её и как кислоту, и как альдегид.
в молекуле которой можно «увидеть» в единстве две функциональные группы: альдегидную и карбоксильную. Эта особенность строения определяет двойственность её химических свойств, т. е. позволяют рассматривать её и как кислоту, и как альдегид.
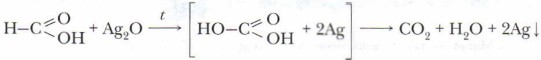

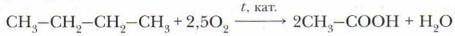
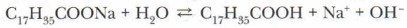

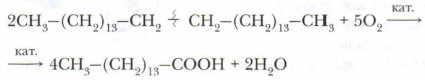
 1. Назовите основные закономерности изменения физических свойств карбоновых кислот в гомологическом ряду и дайте им объяснение.
1. Назовите основные закономерности изменения физических свойств карбоновых кислот в гомологическом ряду и дайте им объяснение.
 2. Составьте структурные формулы муравьиной, уксусной, хлоруксусной кислот и укажите смещение электронной плотности в их молекулах.
2. Составьте структурные формулы муравьиной, уксусной, хлоруксусной кислот и укажите смещение электронной плотности в их молекулах.
 3. Приведите примеры реакций, с помощью которых можно получить пропионовую кислоту; и укажите условия их протекания.
3. Приведите примеры реакций, с помощью которых можно получить пропионовую кислоту; и укажите условия их протекания.
 6. Если дома есть морская соль, проведите несложный домашний эксперимент. Растворите столовую ложку соли в тёплой воде, хозяйственным мылом хорошо намыльте носовой платок и постирайте его в полученном растворе. Что наблюдается?
6. Если дома есть морская соль, проведите несложный домашний эксперимент. Растворите столовую ложку соли в тёплой воде, хозяйственным мылом хорошо намыльте носовой платок и постирайте его в полученном растворе. Что наблюдается?