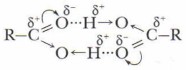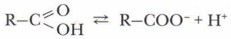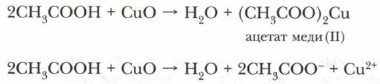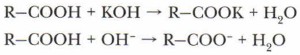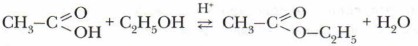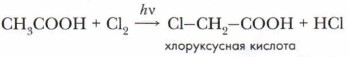|
|
|
|
|
Глава 7. Альдегиды, кетоны, карбоновые кислоты и сложные эфиры § 24. Карбоновые кислоты
Функциональная группа карбоновых кислот — карбоксильная группа
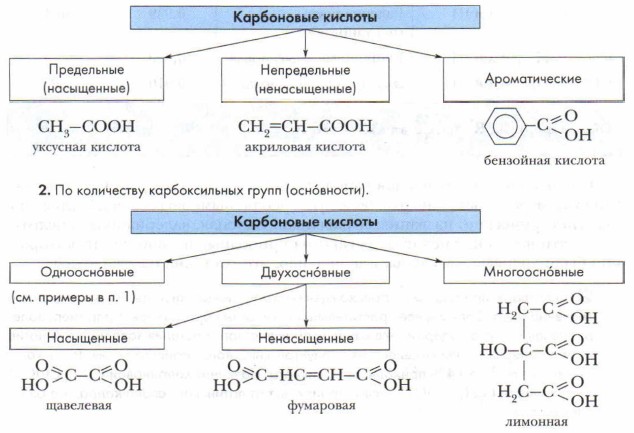
Невозможно и не нужно знать все карбоновые кислоты, но, чтобы не затеряться в их многообразии, обратимся к их классификации. Классификация карбоновых кислот строится по двум признакам: 1) по природе углеводородного радикала; 2) по количеству карбоксильных групп в молекуле кислоты (основности). Классификация карбоновых кислот1. По природе углеводородного радикала.
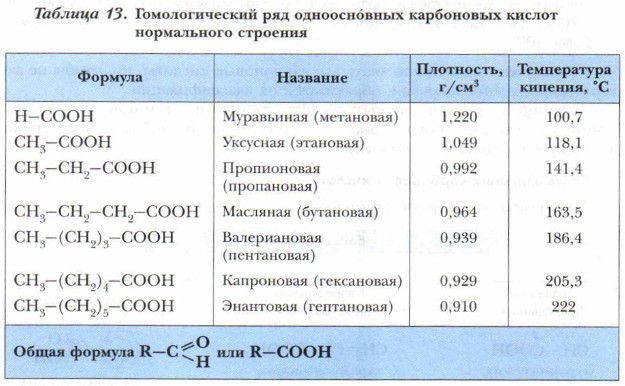
Наиболее простыми и хорошо изученными из кислот являются одноосно́вные предельные насыщенные карбоновые кислоты. Одноосно́вные насыщенные карбоновые кислотыСостав, номенклатура и распространение в природе. Общая формула предельных одноосновных карбоновых кислот R—СООН. По систематической номенклатуре названия этой группы кислот образуются из названий предельных углеводородов с тем же числом углеродных атомов с добавлением суффикса и окончания -овая и слова кислота. Например: метановая кислота, этановая кислота и т. д. (табл. 13).
Однако для первых членов гомологического ряда, который начинает метановая (муравьиная) кислота, более употребляемыми являются их тривиальные (исторические) названия: муравьиная, уксусная, валериановая кислоты и т. д. Эти названия кислот указывают на природные источники, из которых они были впервые выделены. Как правило, это растения или животные.
Задание. Проанализируйте содержание таблицы 13. Какие закономерности изменения физических свойств вы обнаружили? Сравните плотность и температуру кипения одноосновных карбоновых кислот и сделайте заключение о влиянии радикала на их физические свойства. Физические свойства карбоновых кислотВ целом в ряду гомологов с увеличением молекулярной массы уменьшается растворимость в воде и плотность, возрастает температура кипения. Первые три члена гомологического ряда — жидкости, имеющие резкий запах, начиная с масляной кислоты хорошо растворимые в воде — также жидкости, обладающие резким неприятным запахом, но плохо растворимые в воде. Высшие кислоты с числом атомов углерода 10 и более — твёрдые вещества, без запаха, нерастворимые в воде.
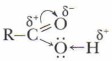
Особенности строения карбоновых кислотПроблема. Почему соединения с группой —СООН относятся к кислотам? Ваши гипотезы и доказательства. В карбонильной, как и в гидроксильной группах, все связи полярны. Усиление полярности связи в гидроксильной группе кислот определяет их способность к образованию более прочных, чем у спиртов, водородных связей. Экспериментально установлено, что кислоты состоят из димеров — удвоенных молекул, образованных водородными связями:
Было обнаружено, что даже в парах уксусной кислоты содержится смесь единичных молекул и димеров, а пары муравьиной кислоты образованы исключительно димерами. Энергия каждой водородной связи в димерах составляет около 7 кДж/моль. Следовательно, относительно высокая температура кипения, а также и растворимость в воде первых гомологов карбоновых кислот объясняются их способностью к образованию водородных связей.
Химические свойства карбоновых кислотХимические свойства карбоновых кислот обусловлены в первую очередь особенностями строения их молекул и функциональных групп. Рассмотрим наиболее характерные свойства карбоновых кислот. 1. Диссоциация карбоновых кислот в воде
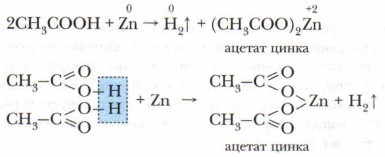
Благодаря наличию в воде иона Н+ они имеют кислый вкус, изменяют окраску индикаторов и проводят электрический ток. В водном растворе эти кислоты — слабые электролиты. С увеличением углеводородного радикала снижается степень диссоциации и сила кислот в разбавленных растворах. Карбоновые кислоты обладают химическими свойствами, характерными для растворов неорганических кислот, т. е. взаимодействуют с металлами, их оксидами, гидроксидами и слабыми солями. 2. Взаимодействие карбоновых кислот с металлами(Активными и среднеактивными) с образованием солей:
3. Взаимодействие карбоновых кислот с оксидами металлов
4. Взаимодействие карбоновых кислот со щелочами
Взаимодействие карбоновых кислот с солями слабых кислотСН3СООН + NaHCO3 → CH3COONa + Н2O + CO2↑ Задание. Запишите ионное уравнение реакции уксусной кислоты с гидрокарбонатом натрия. Как его называют в быту? Что вам известно о практическом применении этой реакции? Взаимодействие карбоновых кислот со спиртамиСпецифическое свойство предельных, карбоновых кислот, осуществляемое за счёт функциональной группы, — взаимодействие со спиртами. Карбоновые кислоты взаимодействуют со спиртами при нагревании и в присутствии концентрированной серной кислоты (как водоотнимающего средства). При нагревании появляется запах этилового эфира уксусной кислоты (этил ацетата):
Реакция протекает за счёт гидроксильных групп исходных веществ. Если в реакционной среде концентрация галогена достаточно высока, реакция галогенирования может продолжаться с замещением второго и третьего атомов водорода. Конечным продуктом хлорирования является трихлоруксусная кислота. Экспериментальные данные подтвердили, что степень диссоциации хлоруксусной кислоты в 88 раз, а трихлоруксусной в 6800 раз выше, чем уксусной.
Проблема. Какова причина такого различия в силе кислот? Дайте объяснения.
|
|
|



 Какие одноосно́вные карбоновые кислоты вам известны? Каково их распространение в природе? Наличие каких химических свойств можно ожидать у одноосно́вных карбоновых кислот?
Какие одноосно́вные карбоновые кислоты вам известны? Каково их распространение в природе? Наличие каких химических свойств можно ожидать у одноосно́вных карбоновых кислот?
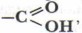 которая является их главным признаком и определяет их химические свойства. Карбоксильная группа может быть рассмотрена как комбинация двух ранее изученных функциональных групп — карбонильной
которая является их главным признаком и определяет их химические свойства. Карбоксильная группа может быть рассмотрена как комбинация двух ранее изученных функциональных групп — карбонильной 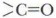 и гидроксильной —ОН.
и гидроксильной —ОН.
 Карбоновых кислот много, они давно известны человечеству. Однако большая их часть присутствует в различных природных источниках в очень небольших количествах. Поэтому многие из них были изучены относительно недавно, благодаря использованию новых методов, например метода газожидкостной хроматографии. Так, в 70-х гг. XX в. было известно около 170 карбоновых кислот, а в настоящее время — более 300.
Карбоновых кислот много, они давно известны человечеству. Однако большая их часть присутствует в различных природных источниках в очень небольших количествах. Поэтому многие из них были изучены относительно недавно, благодаря использованию новых методов, например метода газожидкостной хроматографии. Так, в 70-х гг. XX в. было известно около 170 карбоновых кислот, а в настоящее время — более 300.
 Лабораторный опыт. Рассмотрите образцы и познакомьтесь с агрегатным состоянием и с запахами выданных вам муравьиной, уксусной и стеариновой кислот. (Вспомните, как правильно определять запах веществ!)
Лабораторный опыт. Рассмотрите образцы и познакомьтесь с агрегатным состоянием и с запахами выданных вам муравьиной, уксусной и стеариновой кислот. (Вспомните, как правильно определять запах веществ!)