|
|
|
|
|
Глава 3. Углеводороды § 10. Алканы (окончание)Приведём несколько примеров свободнорадикальных реакций. 1. Реакция нитрования (реакция Коновалова):
Реакция применяется для получения нитросоединений — растворителей, исходных веществ для многих синтезов. 2. Дегидрирование (отщепление водорода). При пропускании алканов над катализатором (Pt, Ni, Cr2O3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена:
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определённых соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение рис. 11. Горение при использовании алканов в качестве топлива (рис. 11):
В общем виде уравнение горения алканов можно записать следующим образом:
Термическое расщепление углеводородов (крекинг) — уже знакомая вам реакция:
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гемолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
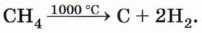
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти. При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества:
При нагревании до температуры 1500 °С возможно образование ацетилена:
Изомеризация. При нагревании линейных углеводородов с катализатором (хлоридом алюминия) образуются алканы с разветвлённым углеродным скелетом:
Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
Каталитическое окисление алканов кислородом. Эти реакции являются основой важнейших промышленных процессов получения кислородсодержащих органических соединений. Спирты, альдегиды, карбоновые кислоты могут образовываться при непосредственном взаимодействии алканов с кислородом в зависимости от условий проведения реакций (катализатора, температуры, давления):
Применение алкановПредельные углеводороды находят очень широкое применение в промышленности (рис. 12). Они являются доступным и достаточно дешёвым топливом, сырьём для получения большого количества важнейших соединений. Соединения, полученные из метана, самого дешёвого углеводородного сырья, применяют для производства множества других веществ и материалов. Метан используют как источник водорода в синтезе аммиака, а также для получения синтез-газа (смесь СО и Н2), применяемого для промышленного синтеза углеводородов, спиртов, альдегидов и других органических соединений (рис. 13). Образование ацетилена (ценного углеводородного сырья и горючего) происходит при нагревании метана до высокой температуры:
Углеводороды более высококипящих фракций нефти используются как горючее для дизельных, турбореактивных двигателей, как основа смазочных масел, как сырьё для производства синтетических жиров и т. д. Как вы уже знаете, углеводороды состава от С5Н12 до С11Н24 входят в бензиновую фракцию нефти и применяются в основном как горючее для двигателей внутреннего сгорания. В таких двигателях воспламенение горючего должно происходить от запальной свечи, которая даёт искру в момент наибольшего сжатия поршнем смеси газов. Однако при сжатии смеси паров бензина с воздухом углеводороды нормального строения образуют перекиси, вызывающие преждевременное воспламенение, что приводит к быстрому износу двигателя и не позволяет использовать его мощность. Это явление называют детонацией. Известно, что наиболее ценными компонентами бензина являются углеводороды с разветвлённой цепью, так как они обладают максимальной детонационной устойчивостью. Наименьшей детонационной устойчивостью среди углеводородов бензиновой фракции
Наиболее устойчив (т. е. в наименьшей степени образует перекиси) так называемый изооктан (2,2,4-триметилпентан):
Изооктан положен в основу условной шкалы оценки бензина по октановым числам. Ему было приписано октановое число 100, а н-гептану — 0. Октановое число 92 (например, бензин А-92) означает, что данный бензин обладает теми же детонационными свойствами, что и смесь, состоящая из 92% изооктана и 8% н-гептана.
В заключение можно добавить, что использование высокооктанового бензина даёт возможность повысить мощность и КПД двигателя внутреннего сгорания.
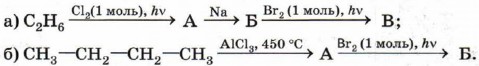
1. Запишите общую формулу углеводородов гомологического ряда алканов. 2. Напишите формулы возможных изомеров гексана и назовите их по систематической номенклатуре. 3. Расшифруйте следующую цепочку превращений. Назовите соединения А, Б и В.
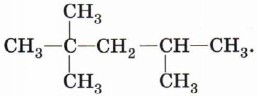
4. Приведите структурную формулу углеводорода С5Н12, образующего при бромировании только одно монобромпроизводное. 5. На полное сгорание 0,1 моль алкана неизвестного строения израсходовано 11,2 л кислорода (н. у.). Какова молекулярная формула алкана?
6. Какова структурная формула газообразного предельного углеводорода, если 7,5 г этого газа занимают объём 5,6 л (н. у.)?
7. Вспомните, что вам известно о применении метана, и объясните, почему утечка бытового газа может быть обнаружена по запаху, хотя метан и его ближайшие гомологи запаха не имеют. 8. Какие соединения могут быть получены каталитическим окислением метана в различных условиях? Напишите уравнения соответствующих реакций. 9. Продукты полного сгорания (в избытке кислорода) 10,08 л (н. у.) смеси этана и пропана пропустили через избыток известковой воды. При этом образовалось 120 г осадка. Определите объёмный состав исходной смеси.
10. Массовая доля углерода в соединении равна 83,3%, водорода — 16,7%. Определите строение вещества, если известно, что при его бромировании образуется только одно монобромпроизводное.
11. Подготовьте сообщение по теме «Жизнь и творчество Нобелевского лауреата, академика Н. Н. Семёнова». Вы можете найти данные о биографии учёного на сайте химического факультета МГУ им. М. В. Ломоносова, если перейдёте по ссылке http://www.chem.msu.ru/rus/history/acad/semenov. html
|
|
|



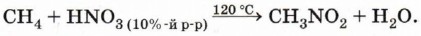
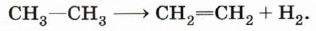

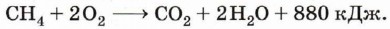
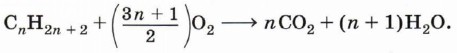
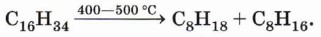
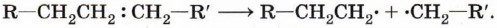


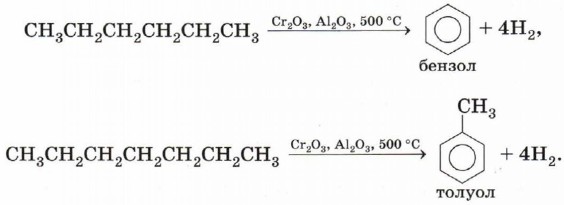
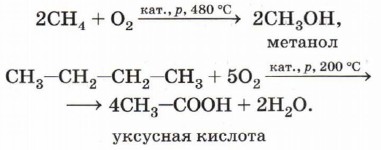
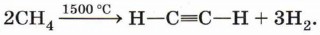
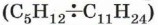 обладает н-гептан.
обладает н-гептан.