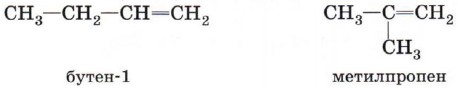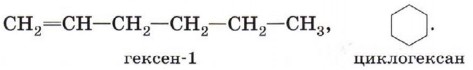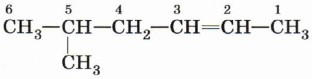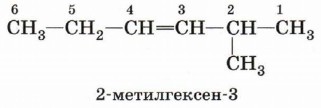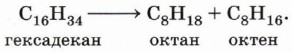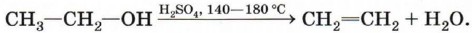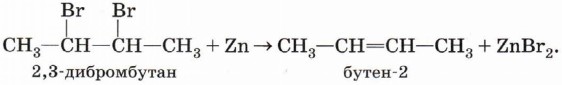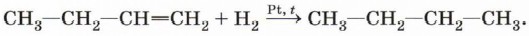|
|
|
|
|
Глава 3. Углеводороды § 11. АлкеныК непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
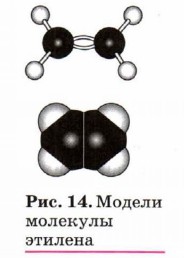
Строение алкеновПо названию первого представителя гомологического ряда — этилена — алкены называют этиленовыми углеводородами. Исторически первое название — олефины (рождающие масло), алкены получили ещё
во времена алхимии. Это название отражало способность этилена вступать в реакции присо единения с образованием органических веществ маслянистой консистенции. Орбитали атомов углерода, между которыми имеется двойная связь (рис. 14), как вы знаете, находятся в состоянии sр2-гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остаётся негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счёт негибридизованных р-орбиталей соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π-связи. Оси гибридных орбиталей атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π-связь, располагаются перпендикулярно плоскости молекулы (см. рис. 5). Двойная связь (0,132 нм) короче одинарной, а её энергия больше, т. е. она является более прочной. Тем не менее наличие подвижной, легко поляризуемой π-связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения. Гомологический ряд этенаНеразветвлённые алкены составляют гомологический ряд этена (этилена): С2Н4 — этен, С3Н6 — пропей, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен и т. д. Изомерия и номенклатура алкеновДля алкенов, так же как и для алканов, характерна структурная изомерия. Структурные изомеры, как вы помните, отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен.
Особым видом структурной изомерии является изомерия положения двойной связи.
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов ещё одного вида изомерии — геометрической, или цис-, транс-изомерии.
Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π-связи, а следовательно, и свойствами. Алкены изомерны циклоалканам (межклассовая изомерия), например:
Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов. Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения
5-метилгексен-2, а не 2-метилгексен-4, как можно было бы предположить. Если по расположению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.
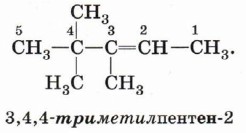
Формирование названия у алкенов происходит так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, -ен. Например:
Получение алкеновКрекинг нефтепродуктов. В процессе термического крекинга предельных углеводородов наряду с образованием алканов происходит образование алкенов (см. § 10 «Алканы»), например:
Дегидрирование предельных углеводородов. При пропускании алканов над катализатором (Pt, Ni, Cr2O3) при высокой температуре (400—600 °С) происходит отщепление молекулы водорода и образование алкена.
Дегидратация спиртов (отщепление воды). Воздействие водоотнимающих средств (H2SO4, Аl2O3) на одноатомные спирты при высокой температуре приводит к отщеплению молекулы воды и образованию двойной связи:
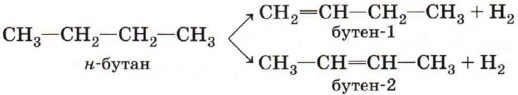
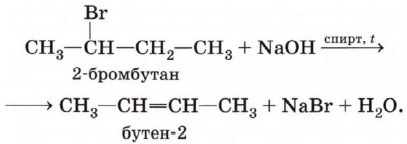
Эту реакцию называют внутримолекулярной дегидратацией (в отличие от межмолекулярной дегидратации, которая приводит к образованию простых эфиров и будет рассмотрена в § 17 «Спирты»). Дегидрогалогенирование (отщепление галогеноводорода). При взаимодействии галогеналкана с щёлочью в спиртовом растворе образуется двойная связь в результате отщепления молекулы галогеноводорода:
Обратите внимание, что в результате этой реакции образуется преимущественно бутен-2, а не бутен-1, что соответствует правилу Зайцева:
Дегалогенирование. При действии цинка или магния на дибромпроизводное алкана происходит отщепление атомов галогенов, находящихся при соседних атомах углерода, и образование двойной связи:
Физические свойства алкеновПервые три представителя гомологического ряда алкенов — газы, вещества состава С5Н10—С16Н32 — жидкости, высшие алкены — твёрдые вещества. Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений. Химические свойства алкеновРеакции присоединенияНапомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования — металлов — платины, палладия, никеля:
Эта реакция протекает и при атмосферном, и при повышенном давлении и не требует высокой температуры, так как является экзотермической. При повышении температуры на техжекатализаторах может пойти обратная реакция — дегидрирование.
|
|
|