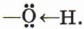|
|
|
|
|
Глава 4. Кислородсодержащие соединения § 18. ФенолыСтроение феноловГидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. В зависимости от этого свойства вещества, вероятно, будут существенно отличаться друг от друга из-за взаимного влияния групп атомов (вспомните одно из положений теории А. М. Бутлерова). И действительно, органические соединения, содержащие ароматический радикал фенил С6Н5—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называют фенолами.
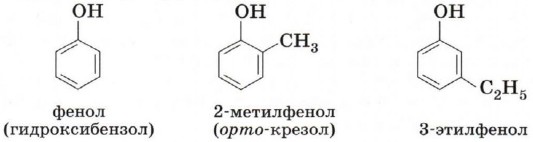
Так же как и спирты, фенолы классифицируют по атомности, т. е. по количеству гидроксильных групп. Одноатомные фенолы содержат в молекуле одну гидроксильную группу.
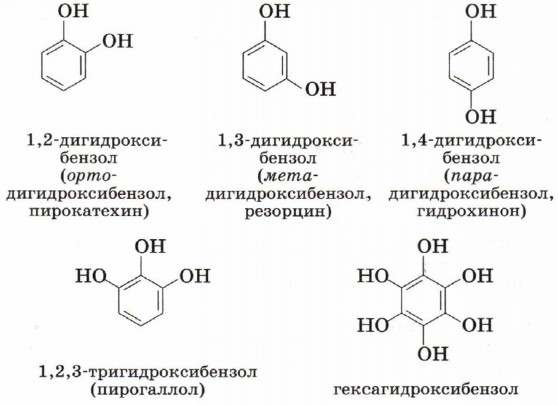
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы.
Существуют и другие многоатомные фенолы, содержащие три и более гидроксильные группы в бензольном кольце. Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом С6Н5ОН (рис. 42). Название этого вещества и легло в основу названия всего класса — фенолы. Физические свойства феноловТвёрдое бесцветное кристаллическое вещество с резким характерным запахом, tпл = 43 °С, tкип = 181 °С. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Тривиальное название фенола — карболовая кислота. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно. Строение молекулы фенолаВ молекуле фенола гидроксил непосредственно связан с атомом углерода бензольного ароматического ядра.
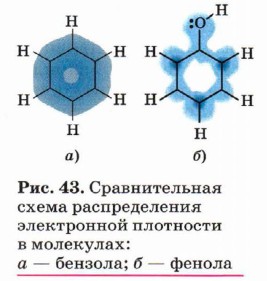
Вспомним строение групп атомов, образующих молекулу фенола. Ароматическое кольцо состоит из шести атомов углерода, образующих правильный шестиугольник, вследствие sр2-гибридизации электронных орбиталей шести атомов углерода. Эти атомы связаны σ-связями. Не участвующие в образовании σ-связей р-электроны каждого атома углерода, перекрывающиеся по разные стороны плоскости σ-связей, образуют две части единого шестиэлектронного π-облака, охватывающего всё бензольное кольцо (ароматическое ядро). В молекуле бензола С6Н6 ароматическое ядро абсолютно симметрично, единое электронное π-облако равномерно охватывает кольцо атомов углерода под и над плоскостью молекулы (рис. 43, а).
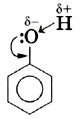
Ковалентная связь между атомами кислорода и водорода гидроксильного радикала сильно полярна. Общее электронное облако связи О—H смещено в сторону атома кислорода. В результате на атоме кислорода возникает частичный отрицательный заряд, а на атоме водорода — частичный положительный заряд. Кроме того, атом кислорода в гидроксильной группе имеет две неподелённые, принадлежащие только ему электронные пары: В молекуле фенола гидроксильный радикал взаимодействует с ароматическим ядром, при этом неподелённые электронные пары атома кислорода взаимодействуют с л-облаком бензольного кольца, образуя единую электронную систему. Такое взаимодействие неподелённых электронных пар и облаков π-связей называют, как вы знаете, р,π-сопряжением (см. с. 148). В результате сопряжения неподелённой электронной пары атома кислорода гидроксигруппы с электронной системой бензольного кольца уменьшается электронная плотность на атоме кислорода. Это снижение компенсируется за счёт большей поляризации связи О—Н, что, в свою очередь, приводит к увеличению положительного заряда на атоме водорода.
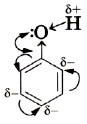
Следовательно, водород гидроксильной группы в молекуле фенола имеет кислотный характер. Сопряжение электронов бензольного кольца и гидроксильной группы сказывается не только на её свойствах, но и на реакционной способности бензольного кольца. В самом деле, как вы помните, сопряжение неподелённых пар атома кислорода с π-облаком бензольного кольца приводит к перераспределению электронной плотности в нём (рис. 43, б). Она понижается у атома углерода, связанного с ОН-группой (сказывается влияние электронных пар атома кислорода), и повышается у соседних с ним атомов углерода, т. е. в положениях 2 и 6, или орто-положениях. Очевидно, что повышение электронной плотности у этих атомов углерода бензольного кольца приводит к локализации (сосредоточению) отрицательного заряда на них. Под влиянием этого заряда происходит дальнейшее перераспределение электронной плотности в ароматическом ядре — смещение её от 3-го и 5-го атомов (мета-положение) к 4-му (орто-положение). Эти процессы можно выразить формулой.
Таким образом, наличие гидроксильного радикала в молекуле фенола приводит к изменению π-облака бензольного кольца, увеличению электронной плотности у 2, 4 и б-го атомов углерода (орто-, пара-положения) и уменьшению электронной плотности у 3-го и 5-го атомов углерода (мета-положения). Локализация электронной плотности в орто- и пара-положениях делает их наиболее вероятными для атак электрофильных частиц при взаимодействии с другими веществами. Следовательно, влияние радикалов, составляющих молекулу фенола, взаимно, и оно определяет его характерные свойства.
|
|
|