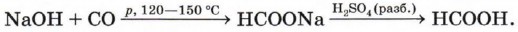|
|
|
|
|
Глава 4. Кислородсодержащие соединения § 20. Карбоновые кислоты (окончание)Отдельные представители карбоновых кислот и их значениеМуравьиная (метановая) кислота НСООН (рис. 47) — жидкость с резким запахом и температурой кипения 100,8 °С, хорошо растворима в воде.
Муравьиная кислота при попадании на кожу вызывает ожоги. Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она также используется при крашении тканей и бумаги (рис. 48). В промышленности муравьиную кислоту получают при нагревании порошко-образного гидроксида натрия с оксидом углерода (II) под давлением 6—8 атм с последующей обработкой полученного формиата натрия разбавленной серной кислотой:
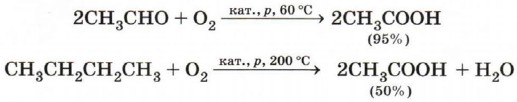
Уксусная (этановая) кислота СН3СООН (рис. 49) — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых отношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса (3— 5% -й раствор) и уксусной эссенции (70—80%-й раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота — сырьё для получения многих важных в техническом отношении органических соединений: например, на её основе получают вещества, используемые для борьбы с сорняками, — гербициды (рис. 50).
Уксусная кислота — основной компонент винного уксуса, характерный запах которого обусловлен именно ей. Как продукт окисления этанола она образуется при хранении вина на воздухе. В промышленности уксусную кислоту получают каталитическим окислением кислородом воздуха уксусного альдегида или бутана.
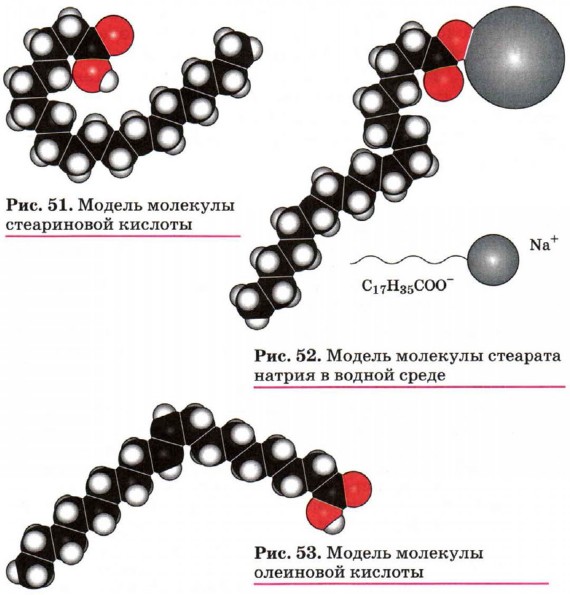
Важнейшими представителями высших предельных одноосновных карбоновых кислот являются пальмитиновая С15Н31СООН и стеариновая С17Н35СООН кислоты (рис. 51). В отличие от низших предельных одноосновных карбоновых кислот, это твёрдые, плохо растворимые в воде вещества. Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их ещё называют мыла́ми (рис. 52). Эти вещества производят в больших масштабах.
СН3—(СН2)7—СН=СН—(СН2)7СООН. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят её соли. Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота НООС—СООН, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — кристаллическое вещество белого цвета, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
1. Непредельная элаидиновая кислота С17Н33СООН является транс-изомером олеиновой кислоты. Составьте структурную формулу этого вещества. 2. Составьте уравнение гидрирования олеиновой кислоты. Назовите продукт этой реакции. 3. Составьте уравнение реакции горения стеариновой кислоты. Какой объём кислорода и воздуха (н. у.) потребуется для сжигания 568 г стеариновой кислоты?
4. Смесь твёрдых жирных кислот — пальмитиновой и стеариновой — называют стеарином (именно из него изготавливают стеариновые свечи). Какой объём воздуха (н. у.) потребуется для сжигания двухсотграммовой стеариновой свечи, если стеарин содержит равные массы пальмитиновой и стеариновой кислот? Определите объём углекислого газа (н. у.) и массу воды образующихся при этом? 5. Пятна ржавчины можно удалить раствором уксусной кислоты. Составьте молекулярные и ионные уравнения происходящих при этом реакций, учитывая, что ржавчина содержит оксид и гидроксид железа (III) — Fe2O3 и Fe(OH)3. Почему такие пятна не удаляются водой? Почему они исчезают при обработке раствором кислоты? 6. Добавляемую в бездрожжевое тесто пищевую соду NaHCO3 «гасят» уксусной кислотой. Проделайте дома эту реакцию и составьте её уравнение, зная, что угольная кислота слабее уксусной. Объясните, чем вызвано образование пены. 7. Расположите следующие кислоты: уксусную, пропионовую, хлоруксусную, дихлоруксусную и трихлоруксусную в порядке усиления кислотных свойств. Обоснуйте своё мнение. 8. Чем можно объяснить, что муравьиная кислота вступает в реакцию «серебряного зеркала»? Составьте уравнение этой реакции. 9. При взаимодействии 3 г предельной одноосновной карбоновой кислоты с избытком магния выделилось 560 мл (н. у.) водорода. Определите молекулярную формулу кислоты.
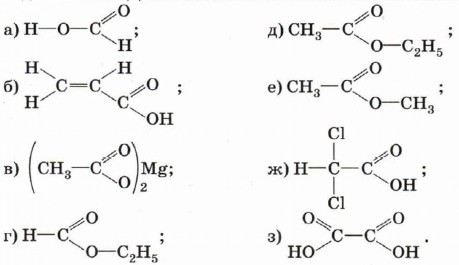
10. Приведите уравнения реакции, с помощью которых можно описать химические свойства уксусной кислоты. Назовите продукты этих реакций. 11. Предложите несложный лабораторный способ распознавания пропионовой и акриловой кислот. 12. Составьте уравнение реакции получения метилформиата — сложного эфира метанола и муравьиной кислоты. В каких условиях следует проводить эту реакцию? 13. Составьте структурные формулы веществ, имеющих состав С3Н6O2. К каким классам веществ их можно отнести? Приведите уравнения реакций, характерных для каждого из них. 14. Вещество А — изомер уксусной кислоты — не растворяется в воде, однако подвергается гидролизу. Какова структурная формула вещества А? Назовите продукты его гидролиза. Составьте структурные формулы следующих веществ: а) метилацетат; д) щавелевая кислота;
16. Назовите вещества, структурные формулы которых приведены ниже. Дайте возможные синонимы их названий.
17. Образец предельной одноосновной органической кислоты массой 3,7 г нейтрализовали водным раствором гидрокарбоната натрия. При пропускании выделившегося газа через известковую воду было получено 5 г осадка. Какая кислота была взята? Вычислите объём выделившегося газа.
18. Выскажите предположение о растворимости уксусной кислоты в этиловом спирте и гексане. Какая из кислот — пропионовая или пальмитиновая — лучше растворяется в воде? Ответ обоснуйте. 19. Используя метод электронного баланса, составьте уравнение реакции: С6Н5СН3 + К2Сr2O7 + H2SO4 → С6H5COOH + ... + ... + H2O. Определите окислитель и восстановитель. 20. Сравните химические свойства органических и неорганических кислот. Найдите черты сходства и различия. Ответ проиллюстрируите уравнениями химических реакции.
|
|
|