|
|
|
|
|
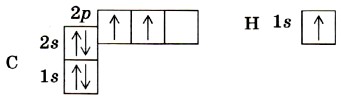
Введение Строение атома углеродаВ атоме углерода первый уровень составляет одна s-орбиталь, на которой находятся два электрона. Второй энергетический уровень атома углерода также содержит s-орбиталь, но большего размера (запас энергии электронов на ней выше, чем у электронов s-орбитали первого уровня), а также три р-орбитали. Это гантелеобразные орбитали одинакового размера, оси которых взаимно перпендикулярны, подобно осям координат х, у и z (см. рис. 2). Каждую орбиталь могут занимать два электрона, но с противоположными значениями спинов. Спин (от англ. to spin — вращаться) — это собственный момент импульса электрона (при введении понятия «спин» в 1925 г. предполагали, что магнитные свойства электрона как заряженной частицы вызваны его вращением вокруг собственной оси). Спин электрона проявляется лишь при взаимодействии его с другими электронами и с внешним магнитным полем. Спин может иметь только два значения: + 1/2 и —1/2» Чтобы представить расположение электронов в атоме, надо помнить, что каждый электрон занимает энергетически наиболее выгодное положение, при котором запас его энергии будет наименьшим. Он всегда стремится занять наиболее близкое к ядру положение и попасть на орбиталь более простой формы (например, сначала на s-, а уж потом на р орбиталь). Если в пределах одного уровня имеется несколько одинаковых орбиталей, электроны размещаются вначале каждый на отдельной орбитали с одинаковыми спинами, а уж затемпопарно, но с противоположными спинами. Соответственно электронная формула атома углерода будет иметь вид 1s22s22p2. Очень часто строение электронных оболочек атомов отображают с помощью электронно-графических формул. В них каждая орбиталь обозначается одной клеткой; каждый электрон — стрелкой; направление стрелки символизирует направление спина. Изобразим электронно-графические формулы атомов углерода и водорода:
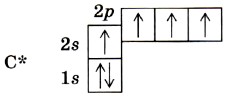
Валентность химического элемента чаще всего определяется числом неспаренных электронов. Атом углерода, как видно из электронно-графической формулы, имеет два неспаренных электрона, поэтому с их участием могут образоваться две электронные пары, осуществляющие две ковалентные связи. Однако в органических соединениях углерод не двух-, а четырёхвалентен. Это можно объяснить тем, что в возбуждённом (получившем дополнительную энергию) атоме происходит распаривание 2s-электронов и переход одного из них на 2р-орбиталь.
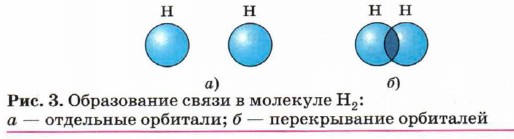
Такой атом имеет четыре неспаренных электрона и может принимать участие в создании четырёх ковалентных связей. Для образования ковалентной связи необходимо,чтобы орбиталь одного атома перекрывалась с орбиталью другого. При этом чем больше перекрывание, тем прочнее связь. В молекуле водорода Н2 образование ковалентной связи происходит за счёт перекрывания s-орбиталей (рис. 3).
Расстояние между ядрами атомов водорода, или длина связи, составляет 7,4 • 10-2 нм, а её прочность — 435 кДж/моль.
|
|
|