|
|
|
|
|
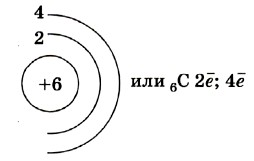
Химия 10 класс. Габриелян § 3. Строение атома углеродаВ настоящее время органическую химию рассматривают как химию соединений углерода, но, отдавая дань уважения истории, по-прежнему продолжают называть её органической химией. Поэтому так важно более подробно рассмотреть строение атома этого элемента, характер и пространственное направление образуемых им химических связей. Атом углерода состоит из ядра, имеющего положительный заряд +6 (так как содержит шесть протонов), и электронной оболочки, на которой находятся шесть электронов, расположенных на двух энергетических уровнях (слоях).
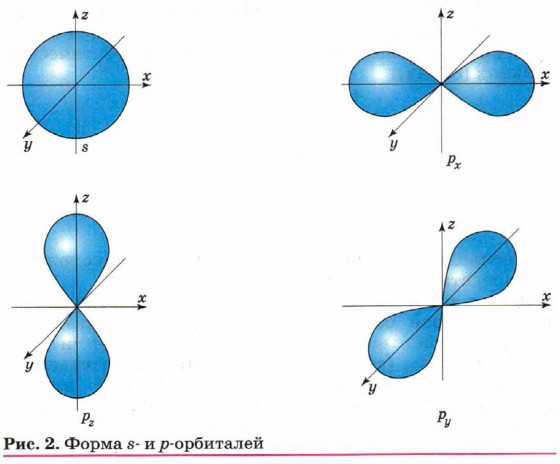
Реальное строение атома углерода гораздо сложнее, чем представлено на приведённой схеме. Дело в том, что движущийся в пространстве вокруг ядра электрон обладает одновременно свойствами и частицы (имеет массу 1/1840 от массы протона или нейтрона), и волны (способен к огибанию препятствий — дифракции, характеризуется определённой длиной волны, амплитудой и частотой колебаний и т. д.). Нельзя точно определить положение электрона в пространстве вокруг ядра. Поэтому говорят о большей или меньшей вероятности пребывания электрона в данной области пространства. Если бы мы могли сфотографировать атом и на снимке положение электрона отражалось бы в виде точки, то при наложении огромного числа таких снимков мы получили бы картину электронного облака. Чем больше плотность этого облака, тем с большей вероятностью электрон находится в этой области. Пространство вокруг ядра, в котором заключено 90% электронного облака, называется орбиталью. Это означает, что 90% времени электрон находится в этом ограниченном пространстве. В дальнейшем мы будем понимать термины «орбиталь» и «облако» как равноценные. Атом углерода имеет два вида орбиталей: s-орбитали сферической формы и р-орбитали в форме гантели или объёмной восьмёрки (рис. 2). Эти орбитали отличаются друг от друга не только формой, но и удалённостью от ядра атома. Чем более удалена от ядра орбиталь, тем большую энергию имеет электрон на этой орбитали. Энергия электрона — важнейшая характеристика его состояния. Причём, и это очень важно, энергия электрона в атоме может принимать только определённые значения, а сам электрон может занимать орбиталь различных энергетических уровней. Эти орбитали отличаются значением энергии находящегося на них электрона.
Чтобы различать энергетические уровни, их нумеруют в порядке удаления от ядра. Ближайший к ядру — первый (1), затем второй (2) и т. д.
|
|
|