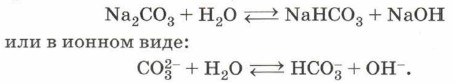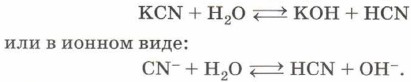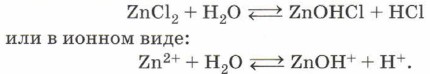|
|
|
|
|
Глава вторая. Химические реакции § 18. Гидролиз
По направлению реакции гидролиза можно разделить на обратимые и необратимые. Если посмотреть на таблицу растворимости гидроксидов и солей в воде, то можно заметить, что в некоторых клеточках этой таблицы стоят прочерки. В сноске же указано, что данное вещество либо не существует, либо разлагается водой, т. е. подвергается необратимому гидролизу. Чаще всего такими солями являются соли, образованные слабым нерастворимым основанием и слабой летучей кислотой. Например, сульфид алюминия существует только в сухом виде, так как в растворе полностью гидролизуется: Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑. Кроме некоторых солей, гидролизу подвергаются многие бинарные (двухэлементные) соединения — фосфиды, нитриды, силициды, гидриды ит.д., например: Zn3P2 + 6Н2O = 3Zn(OH)2↓ + 2РН3↑. Отметим, что эта реакция лежит в основе применения фосфида цинка в качестве зооцида — вещества, используемого для борьбы с грызунами. Необратимый гидролиз используют для получения ацетилена из карбида кальция: СаС2 + 2Н2O = Са(ОН)2 + С2Н2↑. Гораздо более значим и многообразен гидролиз обратимый. Можно выделить четыре типа растворимых солей в зависимости от силы образующих соль кислоты и основания. Необратимый гидролиз соли слабого основания и слабой кислоты был рассмотрен выше на примере сульфида алюминия. Теперь рассмотрим обратимый гидролиз соли сильного основания (щёлочи) и слабой кислоты (H2S, H2CO3, HCN, H2SO3, СН3СООН). Как правило, в результате такого гидролиза образуются кислая соль и щёлочь:
Такой гидролиз называют гидролизом по аниону. Ион, который обусловливает среду раствора, — гидроксид-анион ОН-, поэтому при растворении карбоната натрия в воде среда полученного раствора будет щелочной и индикатор, например фенолфталеин, покажет это, изменив цвет на малиновый. Кислые соли, как продукт гидролиза по аниону, получаются в том случае, если исходная соль образована многоосновной кислотой. В случае же, когда исходная соль образована одноосновной кислотой, в результате гидролиза получаются щёлочь и кислота. В качестве примера рассмотрим гидролиз цианида калия — обязательного атрибута многочисленных шпионских и детективных литературных произведений:
Теперь вам стало понятно, что убивает человека не только цианистый калий, но и образующаяся в результате его гидролиза летучая и чрезвычайно токсичная цианистоводородная кислота HCN. И горьким миндалём пахнет не цианистый калий, а именно циановодород. Гидролиз соли слабого основания (нерастворимого в воде гидроксида металла, аммиака или амина) и сильной кислоты (НСl, HNO3, H2SO4, НСlO4, HBr, HI) приводит, как правило, к образованию сильной кислоты и основной соли:
Такой гидролиз называют гидролизом по катиону. Ион, который обусловливает среду раствора, — катион водорода Н+, поэтому при растворении хлорида цинка в воде среда полученного раствора будет кислотной и индикатор, например лакмус, покажет это, изменив цвет на красный.
|
|
|