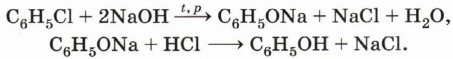|
|
|
|
|
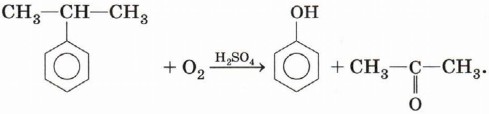
Глава 4. Кислородсодержащие соединения § 18. Фенолы (окончание)Способы получения фенолаПолучение фенола из каменноугольной смолы. Способ, открытый ещё в XIX в., до сих пор широко используется в промышленности (см. § 16). Кумольный способ. В настоящее время это основной промышленный метод получения фенола. Сущность реакции заключается в окислении изопропилбензола (кумола) кислородом воздуха с последующим разложением промежуточных продуктов серной кислотой. Это довольно сложный многоступенчатый процесс. В уравнении реакции мы приведём лишь исходные вещества и конечные продукты:
По данной реакции помимо самого фенола получают ещё один ценный продукт — ацетон. Получение из галогенаренов. При нагревании хлор- или бромпроизводных аренов с щелочами при повышенном давлении получают фенолят щелочного металла, который после обработки сильной кислотой превращают в фенол:
Вспомните, каким образом из бензола получают хлорбензол.
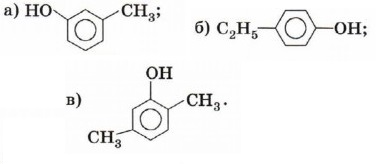
1. Назовите вещества по их структурным формулам,
2. Объясните, почему кислотные свойства фенола выражены сильнее, чем кислотные свойства воды и спиртов. 3. При пропускании углекислого газа через водный раствор фенолята натрия реакционная смесь помутнела и приобрела характерный запах. Объясните изменения и приведите уравнения реакций в молекулярном, полном и сокращённом ионном виде. 4. Смесь предельного одноатомного спирта и фенола массой 3,25 г реагирует с 600 г 2%-й бромной воды. Такая же смесь реагирует с избытком натрия, при этом образуется 448 мл газа (н. у.). Определите молекулярную формулу предельного одноатомного спирта и массовые доли веществ в смеси.
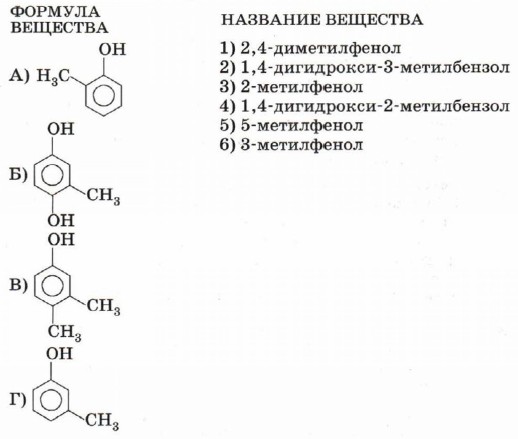
5. В трёх пробирках без подписи находятся водные растворы пропанола-1, глицерина и фенола. С помощью каких реагентов можно определить каждый из растворов? Напишите уравнения соответствующих реакций. 6. Массовые доли углерода и водорода в гомологе фенола равны соответственно 77,78 и 7,41%. Определите формулу вещества. Сколько изомерных фенолов имеют такую формулу? 7. Расположите указанные вещества в порядке усиления кислотных свойств: а) фенол; б) 2-метилфенол; в) 2,4,6-триметилфенол; г) 2,4,6-тринитрофенол; д) 4-нитрофенол. 8. Напишите развёрнутые структурные формулы орто-нитрофенола и пара-нитрофенола. В каком из этих соединений возможно образование внутримолекулярной водородной связи? Между какими атомами? Возможно ли образование межмолекулярнои водородной связи для другого изомера? Выскажите предположение, как образование водородных связей отражается на температуре плавления изомерных нитрофенолов. Свою гипотезу подтвердите или опровергните справочными данными по температуре плавления веществ. 9. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: бензол → изопропилбензол → фенол → фенолят натрия → 2,4,6-тринитрофенол. 10. Установите соответствие между структурной формулой вещества и его названием.
11. Щелочной гидролиз галогеналканов с образованием спиртов протекает сравнительно легко. Напишите уравнение реакции хлорэтана с водным раствором гидроксида натрия. Взаимодействие галогенаренов с щелочами протекает в очень жёстких условиях — при сплавлении реагентов. Выскажите предположение относительно низкой реакционной способности хлорбензола в реакциях нуклеофильного замещения. Напишите уравнение реакции хлорбензола с гидроксидом калия.
|
|
|